【背景介紹】 糖尿病會引起多種並發症,在中老年人群中,糖尿病心髒病是糖尿病患者致死的主要原因之一,尤其是在2型糖尿病患者中。 廣義的糖尿病心髒病包括冠狀動脈粥樣硬化性心髒病(冠心病),糖尿病心肌病和糖尿病心髒自主神經病變等。糖尿病心髒病與非糖尿病患者相比,常起病比較早,糖尿病患者伴冠心病常表現為無痛性心肌梗死,梗死麵積比較大,穿壁梗死多,病情多比較嚴重,預後比較差,病死率較高;如冠狀動脈造影和臨
【背景介紹】
糖尿病會引起多種並發症,在中老年人群中,糖尿病心髒病是糖尿病患者致死的主要原因之一,尤其是在2型糖尿病患者中。
廣義的糖尿病心髒病包括冠狀動脈粥樣硬化性心髒病(冠心病),糖尿病心肌病和糖尿病心髒自主神經病變等。糖尿病心髒病與非糖尿病患者相比,常起病比較早,糖尿病患者伴冠心病常表現為無痛性心肌梗死,梗死麵積比較大,穿壁梗死多,病情多比較嚴重,預後比較差,病死率較高;如冠狀動脈造影和臨床排除冠狀動脈病變,糖尿病患者出現嚴重的心律失常、心髒肥大、肺淤血和充血性心力衰竭,尤其是難治性心力衰竭,臨床可考慮糖尿病心肌病。
其中,糖尿病性心肌病(DCM)是比較有代表性的疾病。由於它隻發生於糖尿病的患者,不能夠用高血壓性心髒病、冠狀動脈粥樣硬化性心髒病以及其他心髒病變來解釋的心肌疾病這種情況。
它是由於在代謝紊亂、以及微血管病變的基礎上會發生廣泛的局灶性的心肌壞死,產生的病因和心肌細胞代謝紊亂,心肌細胞的鈣轉運缺陷有一定關係【1】。如果治療不當,心髒纖維化和肥大會導致心力衰竭甚至死亡【2】。
【發病機製】
細胞焦亡(細胞炎性壞死)是一種在炎症存在下發生的程序性細胞死亡【3】,其特征是細胞持續增大直至細胞膜破裂,從而引發明顯的炎症反應。為了應對不同類型的刺激(如高血糖環境),細胞會產出各種NRL受體,如NLRP3炎性小體。然後激活裂解caspase-1(cl-Caspase-1,一種蛋白水解酶)。cl-Caspase-1裂解成孔細胞死亡執行因子gasdermin-D(GSDMD),GSDMD易位至膜形成孔,導致白細胞介素(IL)-18和IL-1β的釋放【3、4】。
細胞焦亡涉及多種心血管疾病,例如心肌梗死【5、6】、缺血再灌注損傷【7】,和心肌病【8、9】等。所有這些研究表明,尋找一種針對DCM細胞焦亡的幹預措施,是預防和治療糖尿病性心肌病的有效途徑。
DCM的另一種發病機製是纖維化,以心室重構為主要標誌,導致心室壁僵硬和舒張功能障礙,最終誘發心力衰竭。高胰島素血症和高血糖會刺激DCM中腎素血管緊張素-醛固酮通路的激活,從而導致轉化生長因子-β1(TGF-β1)的激活【10】。
TGF-β1是一種促纖維化細胞因子,可使Smad磷酸化。因此,TGF-β1/Smad信號通路充當下遊效應器,修飾靶基因表達並最終導致心髒纖維化和收縮/舒張功能障礙【11】. TGF-β1已成為抗纖維化治療最重要的靶點之一【12】,對延緩病情進展,減少心力衰竭的發生具有重要意義。
因此,尋找能夠選擇性抑製細胞焦亡、纖維化的有效幹預措施,對於預防DCM具有重要的臨床意義。
【氫氣用於DCM治療的可行性分析】
氫氣通過選擇性地減少細胞氧自由基,特別是最有害的活性氧(ROS),起到治療性抗氧化劑的作用【13】。近年來,氫氣已被證明具有抗炎、抗氧化和抗纖維化的特性【14、15】。越來越多的證據表明,氫氣對缺血性心髒病有效【16】、小腸和肺的缺血再灌注損傷【17、18】,失血性休克【19】。
二甲雙胍作為時下治療糖尿病的一線藥物【20】,已被證明具有降血糖作用和心髒保護作用【21】。但是,肝腎功能不全限製了它的高劑量使用【22】。氫氣吸入具有多種作用機製,無副作用、安全且易於使用【23、24】,因此,氫聯合二甲雙胍可能是一種新的治療策略。
【研究實驗】
來自中國哈爾濱醫科大學第四附屬醫院心內科、檢驗科的團隊,進行了這方麵的研究,其成果發表在《Free Radical Biology and Medicine》上麵。
實驗選用4周齡雄性C57BL/6小鼠,將小鼠隨機分為五組:分別為對照組(n = 10)、糖尿病組(DM,n = 10)、吸入氫氣治療組(DM + H2,n = 10)、二甲雙胍治療組(DM + Met , n = 10)和用二甲雙胍和氫氣治療組(DM+Met+H2,n=10)。所有小鼠都在標準條件下被圈養和適應環境,並喂食正常食物直至研究結束。
然後,為糖尿病組小鼠建立糖尿病模型(血糖值≥16.7 mmol/L證實糖尿病模型建立成功)【25,26】。接下來,各組按下列方式進行治療。吸入氫氣治療組,每天吸入2%氫氣3小時;二甲雙胍治療組,在飲用水中加入二甲雙胍(200 mg/kg/d,Sigma)【25、27】;二甲雙胍和氫氣治療組,接受氫氣和二甲雙胍聯合治療。所有小鼠飼養8周,之後進行相關檢測。
【實驗結果】
實驗結果一:氫氣改善了糖尿病小鼠的心功能障礙和異常形態結構
研究團隊通過超聲心動圖用於評估心髒功能的變化。糖尿病組小鼠有明顯的心髒收縮和舒張功能障礙,這種改變在氫氣指治療組中大大減少。
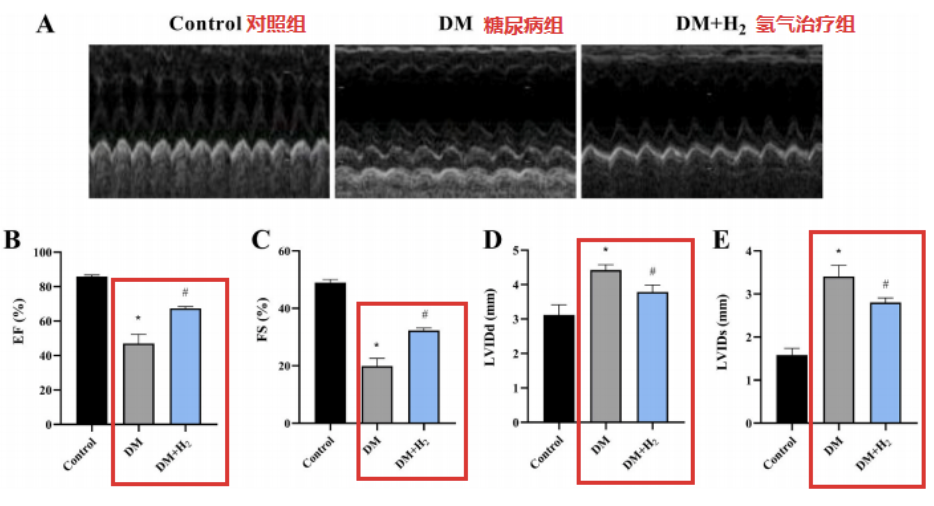
這些變化顯示在左心室射血分數(EF%)、左心室短軸縮短率(FS%)、舒張末期左心室內徑(LVIDd)和收縮末期左心室內徑(LVIDs)的數據對比中。
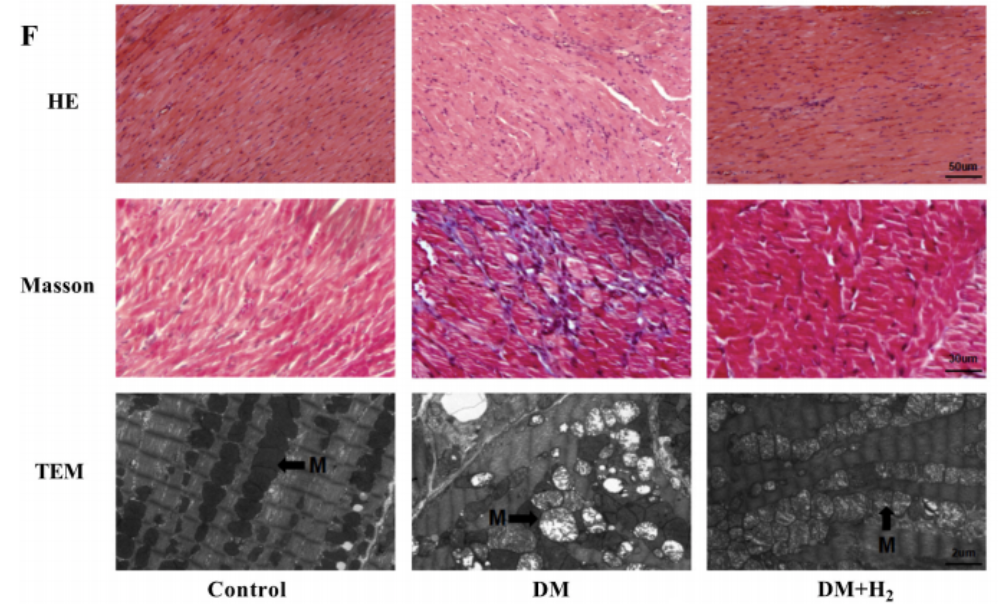
糖尿病組小鼠的心肌表現出嚴重的肌節紊亂和線粒體(M)腫脹,這在對照組中未見,氫氣治療組的肌節紊亂和線粒體腫脹明顯減少。
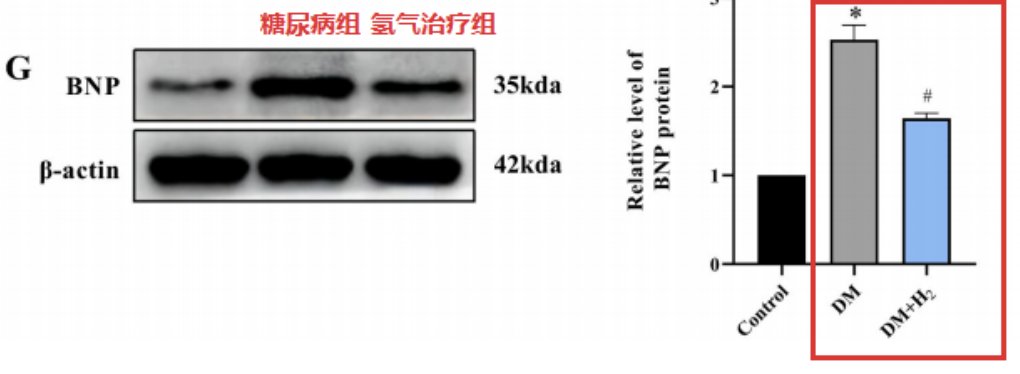
糖尿病組的腦利鈉肽(BNP)濃度顯著升高,這種變化在氫氣治療組中被逆轉。綜上所述,這些數據表明氫氣可以減輕心髒功能障礙和異常。
結果二:氫氣可降低糖尿病小鼠NLRP3介導的細胞焦亡蛋白的表達
為了確定氫對糖尿病小鼠細胞焦亡的療效,研究團隊觀察了細胞焦亡相關的蛋白質水平。
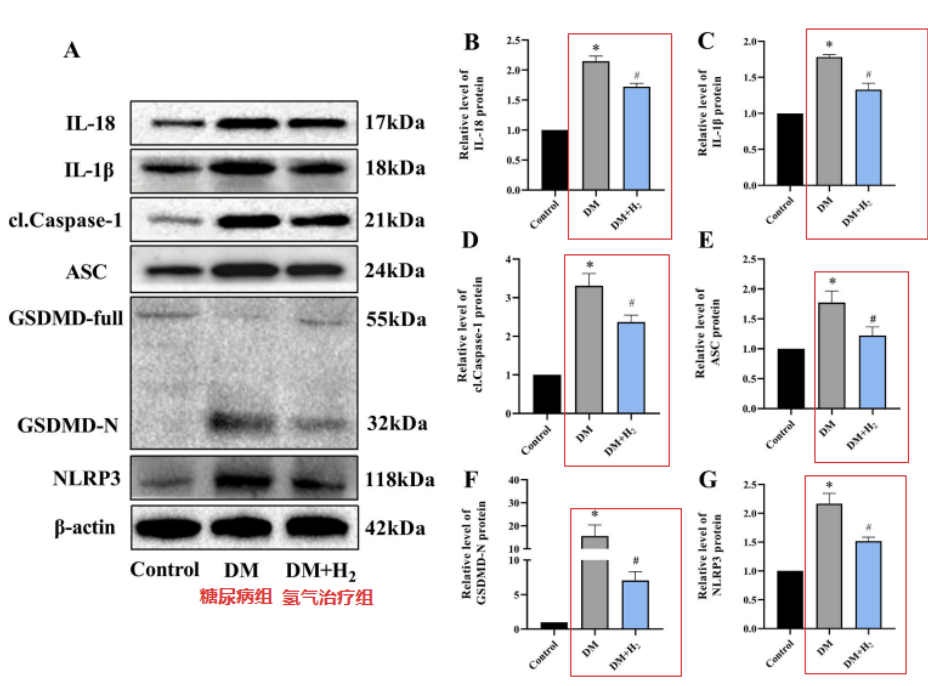
結果發現,NLRP3、cl-Caspase-1、ASC、IL-18、IL-1β和GSDMD-N水平在糖尿病組小鼠中升高;而氫氣吸入治療,有效地恢複了這些炎症細胞因子水平。
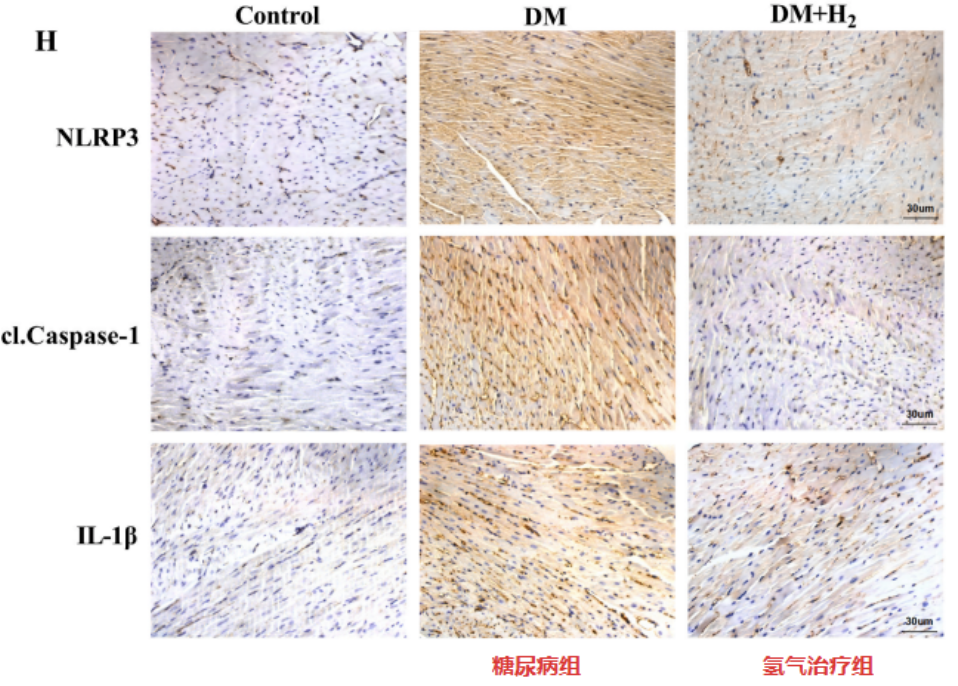
另外,與糖尿病組小鼠比較,氫氣治療組小鼠NLRP3、cl-Caspase-1和IL-1β水平較低。以上結果說明氫氣可以減少糖尿病小鼠的心髒NLRP3相關細胞焦亡。
結果三:氫氣可降低糖尿病小鼠TGF-β1介導的纖維化蛋白的表達
過度心肌纖維化是擴張型心肌病的另一個重要特征,給治療帶來困難。TGF-β1/Smad信號通路在心肌纖維化進程中起著至關重要的作用【10、11】。為了驗證氫氣對糖尿病小鼠心肌纖維化的療效,研究團隊觀察了纖維化相關蛋白水平。
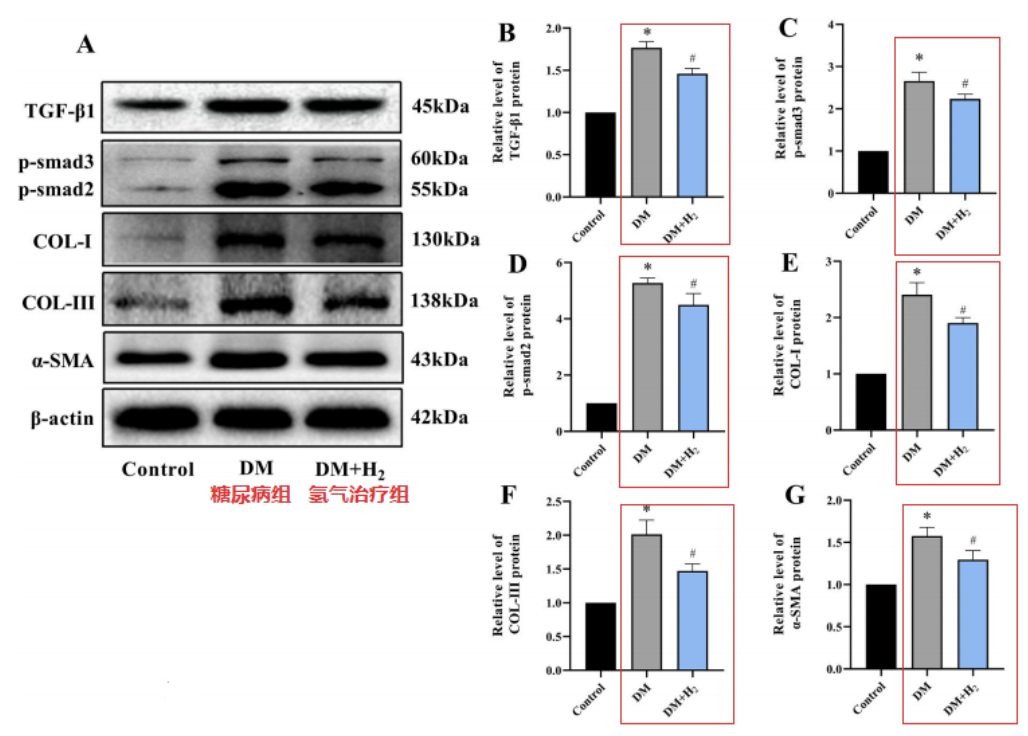
與對照組相比,糖尿病組小鼠的TGF-β1、p-smad3、p-smad2、COL-I、COL-III和α-SMA水平顯著升高,而這些蛋白水平在經過吸入氫氣治療後顯著降低。
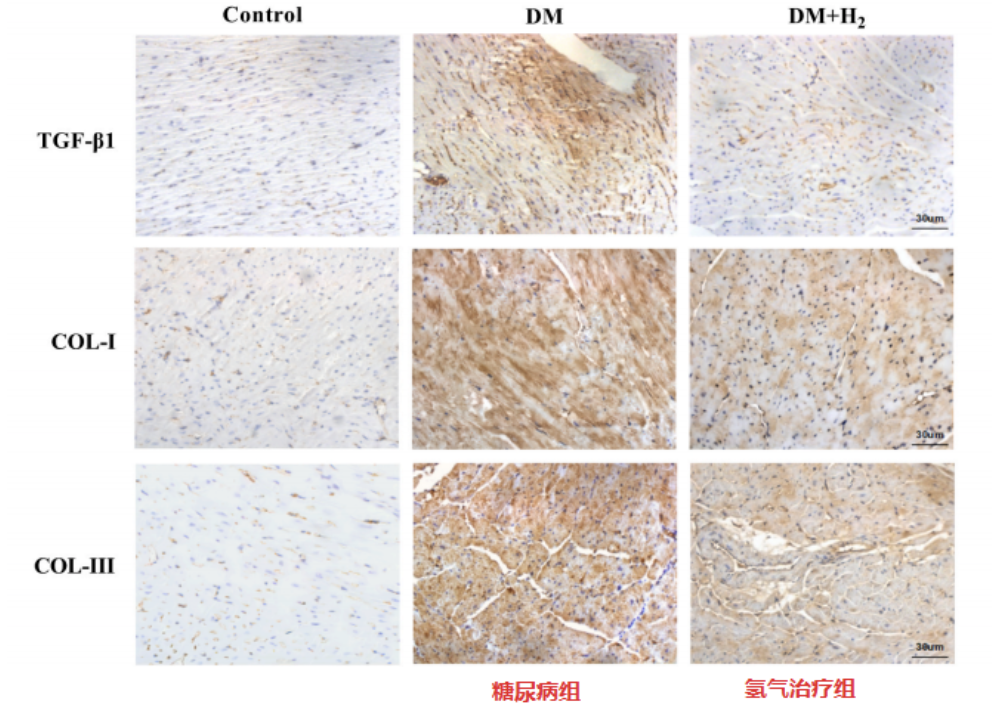
免疫組織化學染色測試,也證明了這些發現,表明氫氣吸入降低了糖尿病組組中TGF-β1、COL-I和COL-III的水平。以上結果表明氫氣可以減輕糖尿病小鼠的心髒纖維化。
結果四:在高血糖(HG)條件下吸入氫氣,通過減少AMPK/ mTOR/NLRP3信號通路抑製細胞焦亡
在確認氫在減輕糖尿病小鼠細胞焦亡中的作用後,下一步是闡明其潛在機製。既往研究證實,富氫鹽水可通過AMPK/mTOR信號通路減少內毒素引起的急性肺損傷【28】,二甲雙胍通過AMPK/mTOR途徑減輕【25】糖尿病。推測氫也可能通過介導糖尿病組中的AMPK/mTOR/NLRP3通路來抑製細胞焦亡。
為了更好地理解氫、AMPK和NLRP3之間的相互作用,研究團隊提取了原代心肌細胞,並在用氫幹預高糖環境(標記為HG+H2)和不用氫幹預的高糖環境(標記為HG)處理的5.0 mmol/L(對照)和30 mmol/L葡萄糖中生長。Compound C(標記為CC)是一種選擇性,ATP競爭性的AMPK抑製劑,被證明可加重高葡萄糖誘導的細胞損傷,並充當阻斷劑,采用氫幹預高糖環境,添加Compound C(標記為HG+H2+CC)對高糖處理的心肌細胞進行給藥處理。
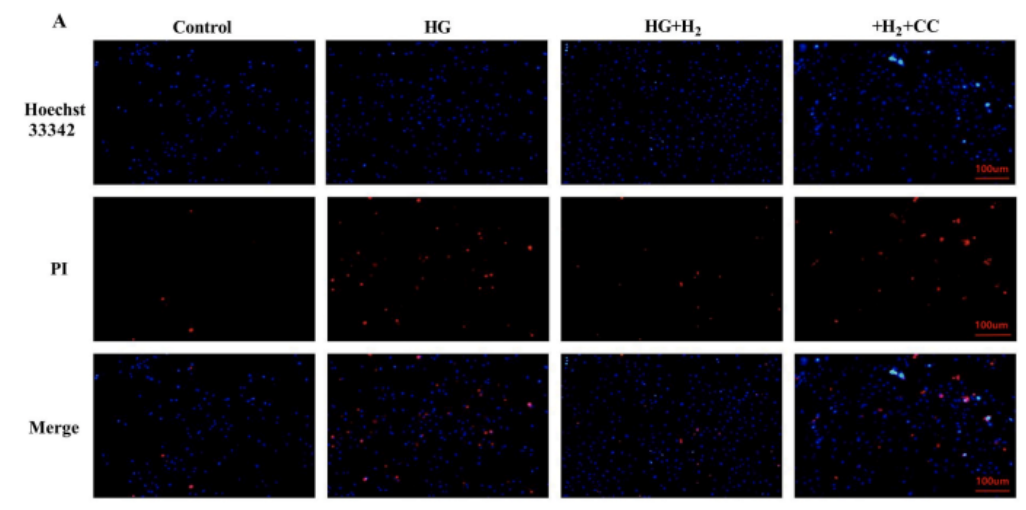
采用Hoechst33342/PI雙熒光染色檢測高糖誘導的細胞死亡,結果顯示高糖誘導的原代心肌細胞死亡增加被氫氣逆轉,而這種保護作用被CC幹預破壞。
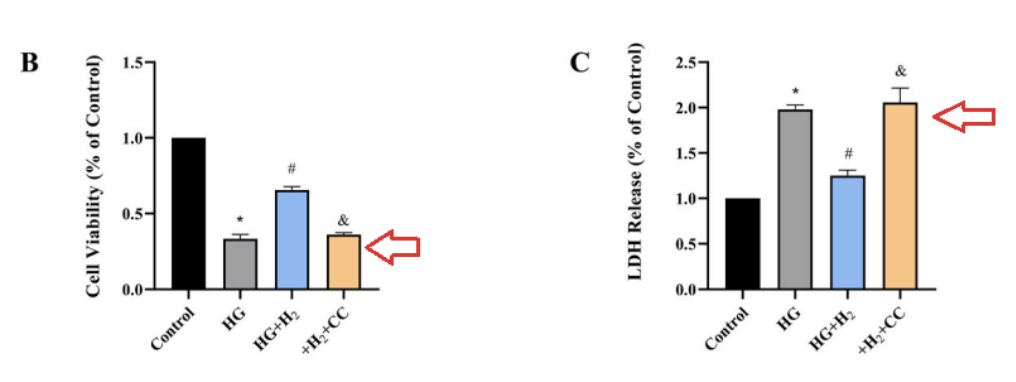
通過CCK8測定和LDH釋放測定,檢測心肌細胞的活性和損傷程度,結果與Hoechst33342/PI雙熒光染色的結果一致,表明CC破壞了氫的保護作用。
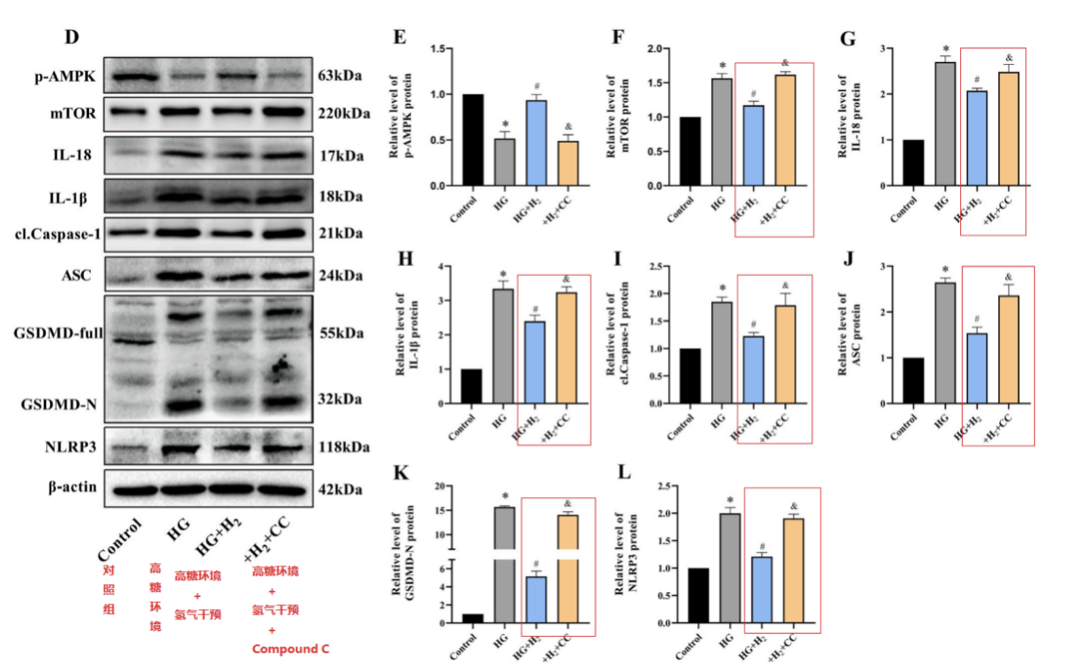
隨後,經過Western blot檢測,顯示HG組的p-AMPK水平降低。經過氫氣治療後HG+H2組mTOR、IL-18、IL-1β、cl-Caspase-1、ASC、GSDMD-N和NLRP3的水平顯著低於HG組;這種保護作用被CC破壞了(HG+H2+CC)。這些發現表明氫通過AMPK/mTOR/NLRP3軸抑製細胞焦亡。
結果五:高糖環境下吸入氫氣,通過抑製TGF-β1/Smad通路減輕纖維化
在確認氫氣減輕糖尿病小鼠的心肌纖維化以及氫氣降低TGF-β1、p-smad3和p-smad2的水平後,研究團體探索氫氣與TGF-β1的關係。
取心髒成纖維細胞,並在用氫幹預高糖環境(HG + H2)或不用氫氣幹預的高糖環境(HG),處理的5.5 mmol/L(對照)和30 mmol/L葡萄糖溶液中培養;將外源性TGF-β1於用氫氣幹預的高糖環境中(標記為HG + H2+TGF-β1)。
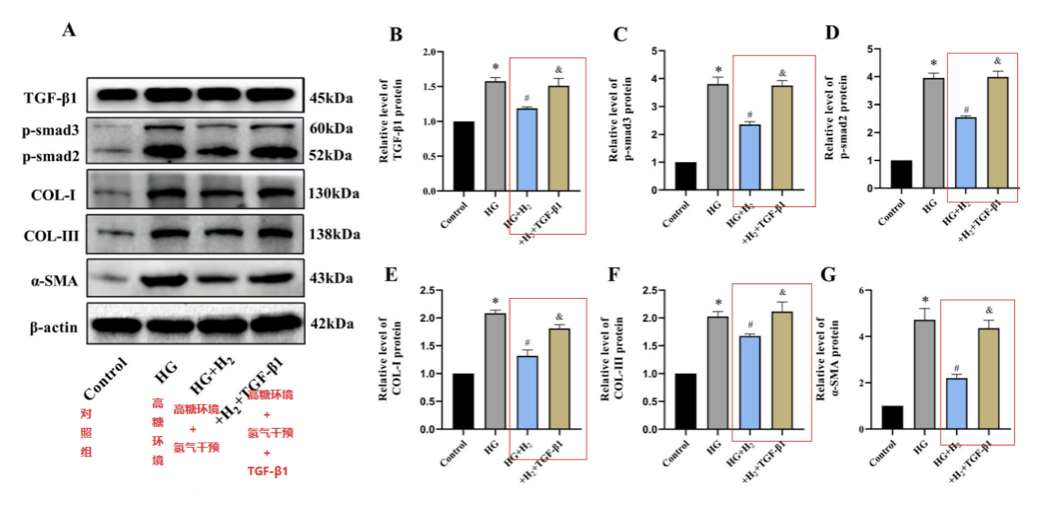
根據蛋白質印跡,TGF-β1、p-smad3、p-smad2、COL-I、COL-III和α-SMA水平在不用氫氣幹預的高糖環境中顯著更高;經過氫幹預高糖環境(HG + H2)處理後,水平顯著降低;在添加了外源性TGF-β1,氫氣的保護作用被破壞。
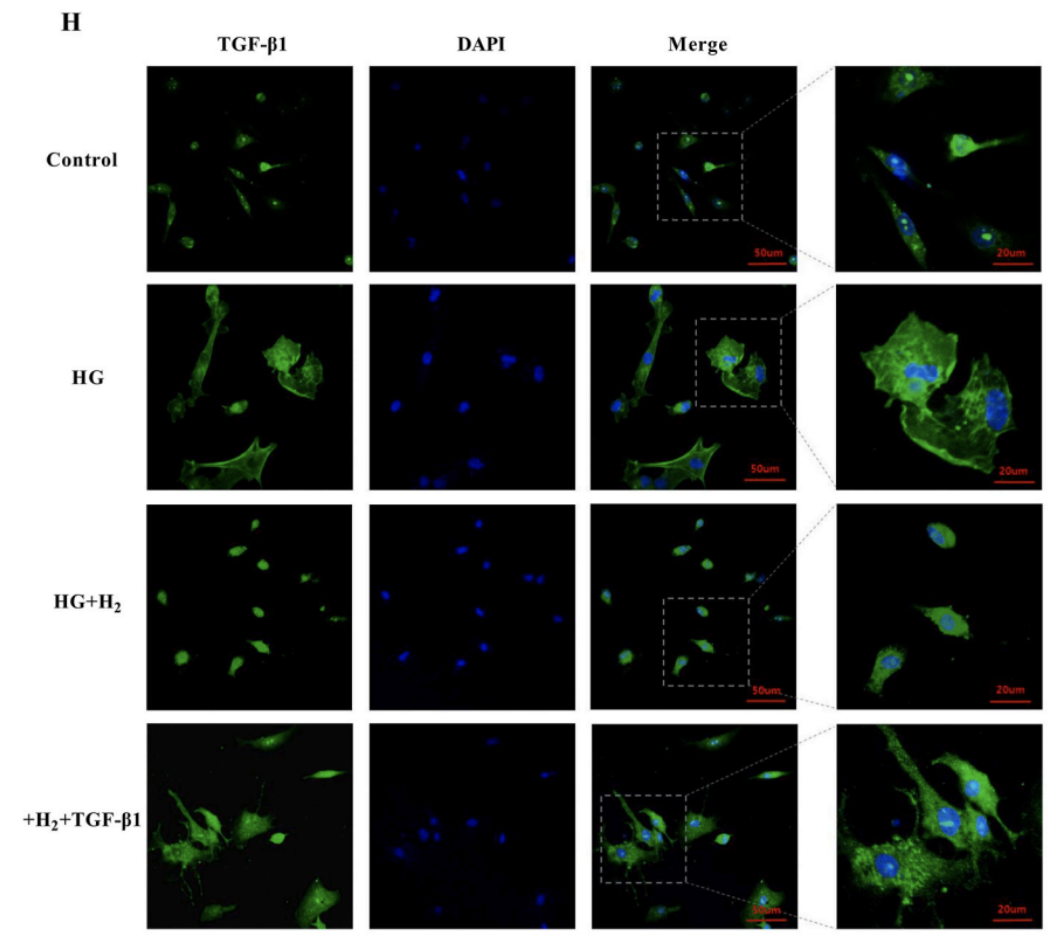
TGF-β1的免疫熒光檢測證實了這一發現
心髒成纖維細胞(CFs)遷移是病理性纖維化的另一個原因。Transwell(用於檢測細胞遷移)用於評估氫氣對CFs遷移的影響。

結果表明,在不用氫氣幹預的高糖環境中(HG)增加了CFs在心底中的遷移,氫氣幹預(HG+H2)有效地阻止了遷移,但這種保護作用,被外源性TGFβ1破壞。
結果六:二甲雙胍+氫氣治療抑製糖尿病引起的小鼠組織病理學改變
盡管二甲雙胍是一線藥物,但由於擔心副作用風險增加,在肝腎功能不全患者中大劑量使用曆來是禁忌的【22】。氫氣是一種生理惰性氣體,不會與任何活性化合物發生反應【29】,非常易於使用。接下來,研究團隊分析了糖尿病小鼠對二甲雙胍和氫氣聯合給藥的反應。
實驗人員將小鼠分為5組,對照組(n = 20)、糖尿病組(DM,n = 20)、吸入氫氣治療組(DM + H2,n = 20)、二甲雙胍治療組(DM + Met , n = 20)和用二甲雙胍和氫氣治療組(DM+Met+H2,n=20)。2個月後,各組存活數量依次為20、10、14、13、17。
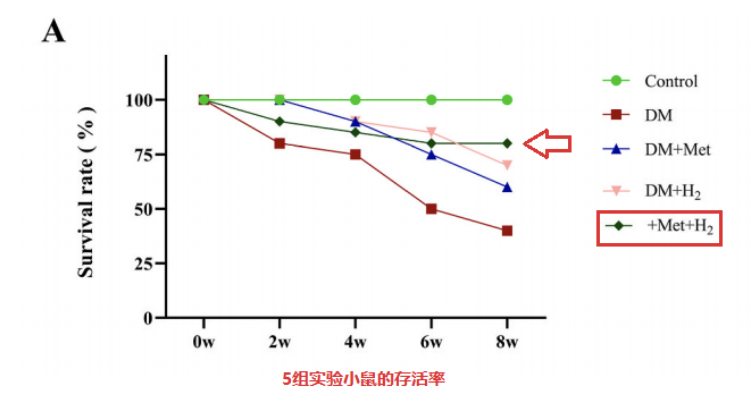
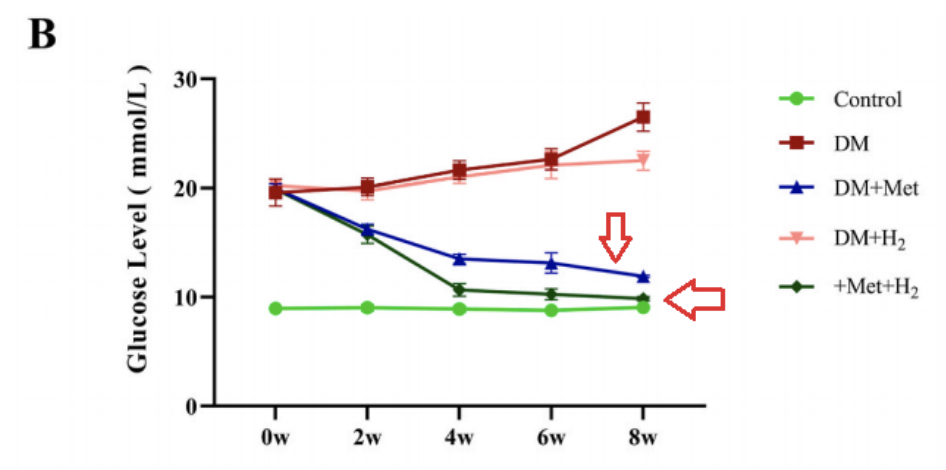
二甲雙胍和氫氣處理均提高了小鼠的存活率,而二甲雙胍和氫氣聯合給藥表現出更顯著的保護作用,另外,單獨使用二甲雙胍(DM + Met)或與氫氣聯合使用(DM + Met + H2)可顯著降低空腹血糖水平。與DM組相比,DM+H2組空腹血糖水平略有降低。
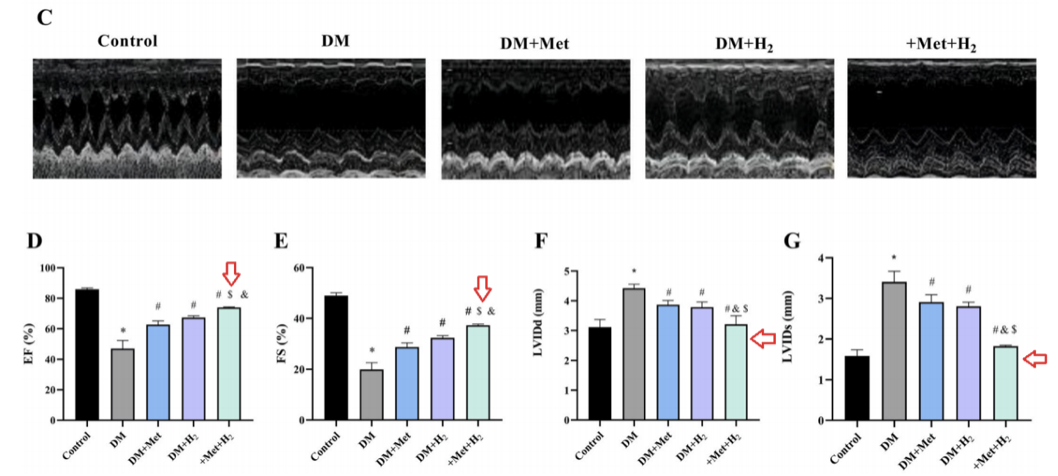
左心室射血分數(EF%)、左心室短軸縮短率(FS%)增加,舒張末期左心室內徑(LVIDd)和收縮末期左心室內徑(LVIDs)減少,表明氫氣聯合二甲雙胍治療,比單一治療發揮更顯著的效果。
HE染色(蘇木精-伊紅染色法)顯示糖尿病組心肌結構異常、肥厚,單次服用二甲雙胍或氫氣可減輕這種心肌結構異常、肥大,而同時聯合服用二甲雙胍和氫氣效果更顯著。
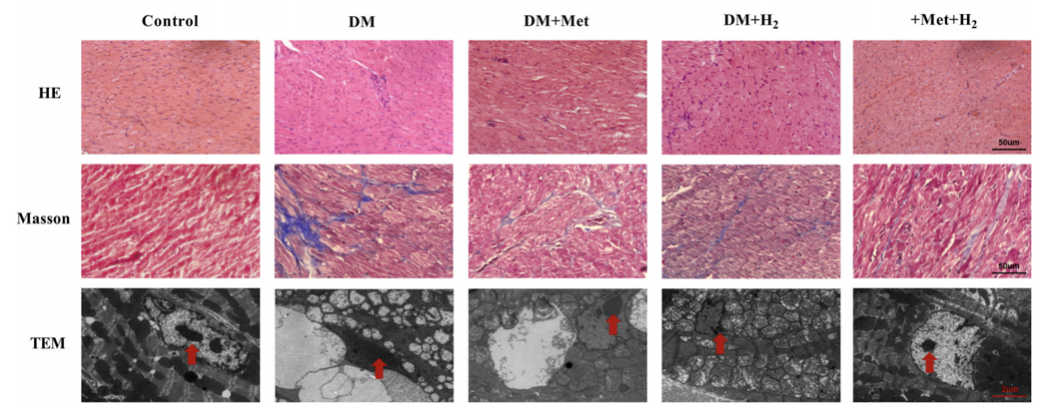
Masson染色(固綠法)顯示DM+Met+H2組間質纖維化程度低於單一治療組。此外,透射電子顯微鏡顯示,糖尿病組肌節(肌原纖維節,是肌原纖維的基本單位)紊亂、線粒體腫脹、細胞核固縮;而在DM+Met、DM+H2組中,這種問題得到緩解;在DM+Met+H2組中,肌節紊亂、線粒體腫脹、核固縮等損傷幾乎完全消除。
結果七:與單獨幹預相比,二甲雙胍聯合氫氣幹預,減少了糖尿病小鼠的細胞焦亡和纖維化
氫氣抑製糖尿病小鼠模型中的細胞焦亡和纖維化,二甲雙胍已被證明具有抗細胞焦亡和抗纖維化特性【25、30】。研究團隊通過蛋白質印跡和免疫組織化學測定蛋白質,評估二甲雙胍和氫氣聯合給藥對糖尿病小鼠細胞焦亡相關蛋白和纖維化相關蛋白表達的影響。
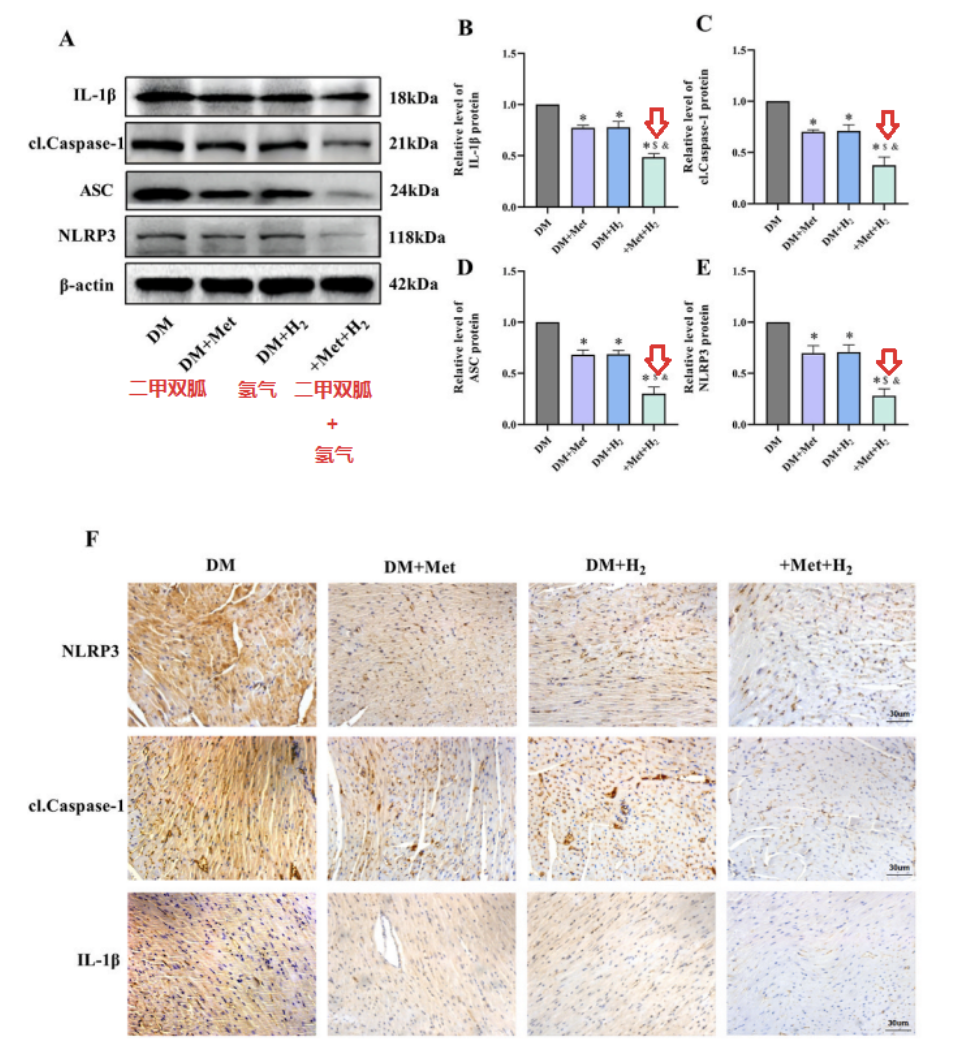
二甲雙胍和氫均降低了NLRP3、cl-Caspase-1和IL-1β的表達,而聯合治療更顯著降低了蛋白質表達水平。
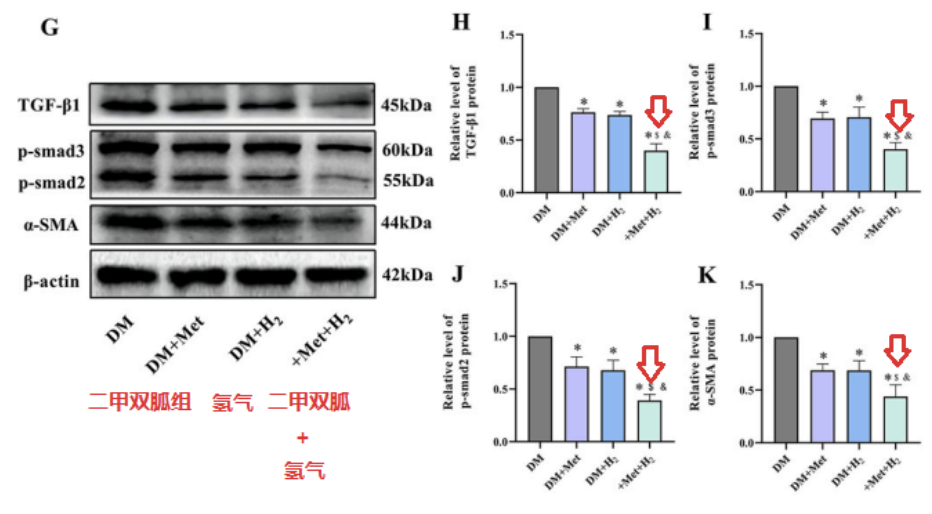
Western blot檢測,也發現DM + Met+ H2組的TGF-β1、p-smad3、p-smad2和α-SMA水平,低於DM+H2和DM+Met組。
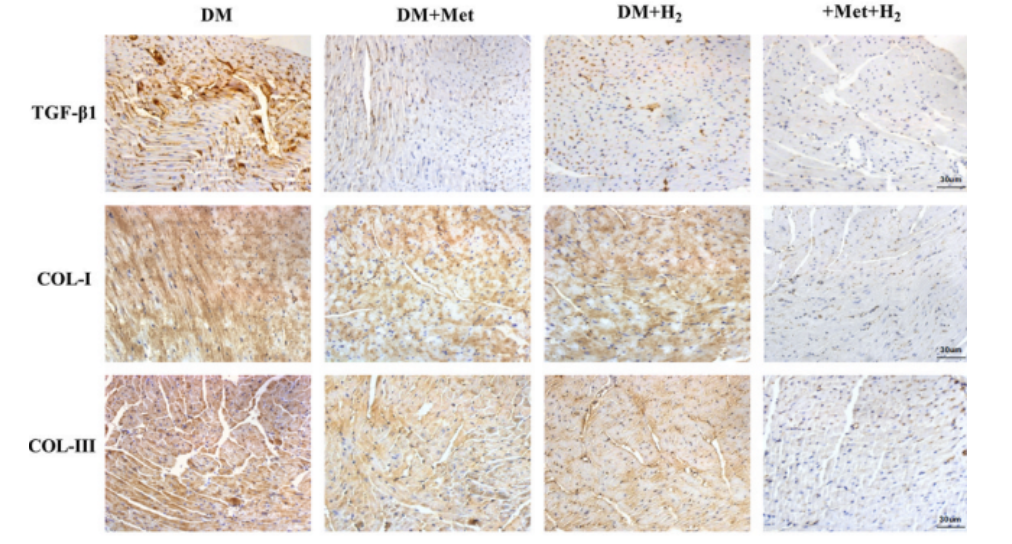
此外,免疫組織化學檢測,也證實了類似的現象。這些結果表明,與單獨給藥相比,二甲雙胍和氫氣的共同給藥,對DCM顯示出更好的抗細胞焦亡和抗纖維化作用。
結果八:在高血糖(HG)環境下,二甲雙胍聯合氫氣幹預,進一步減輕了細胞損傷。
根據cck-8檢測(細胞增殖毒性檢測),高血糖會顯著降低心肌細胞的活性。
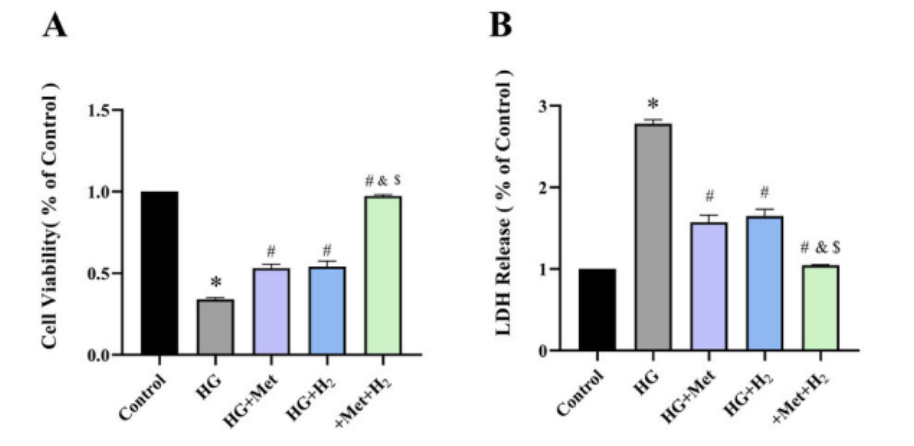
二甲雙胍和氫氣都增加了暴露於高血糖的心肌細胞的活性,而二甲雙胍和氫氣的共同給藥,提供了更好的保護作用(圖A);LDH釋放試驗結果也驗證了上麵的結論(圖B)。
蛋白質印跡分析的結果表明,高血糖上調了細胞焦亡相關蛋白,包括IL-1β、cl-Caspase-1、ASC和NLRP3。
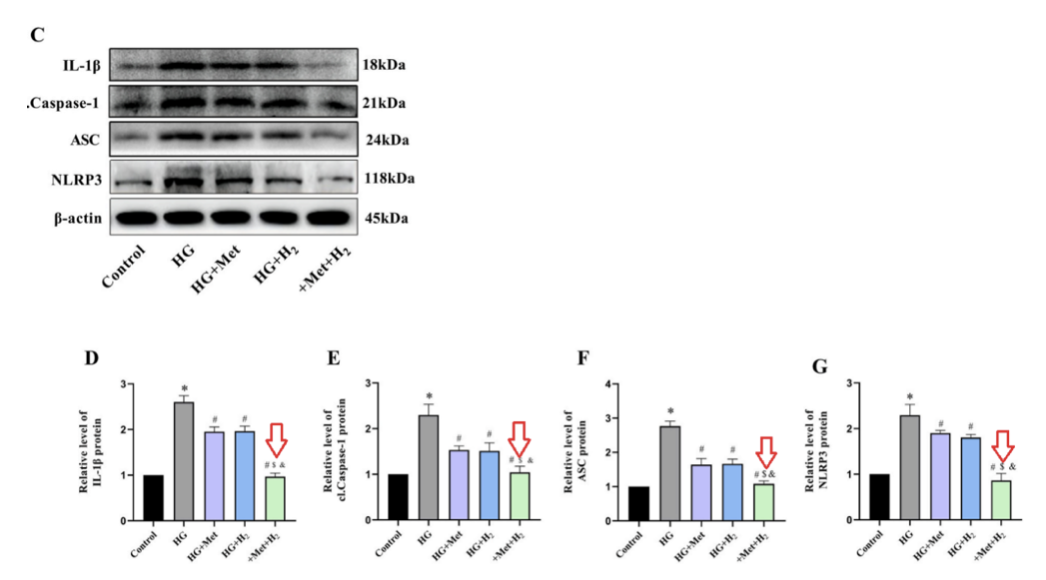
而二甲雙胍和氫氣的共同給藥組的的蛋白表達水平,顯著低於單一治療組。這些數據表明,二甲雙胍和氫氣的共同給藥可以減少高血糖條件下的細胞焦亡,從而最大限度地減少細胞損傷。
結果九:在高血糖環境下,二甲雙胍聯合氫氣幹預,進一步緩解了纖維化。
Western blot檢測發現,高血糖環境增加了纖維化相關蛋白TGF-β1、p-smad3、p-smad2、COL-I、COL-III、α- SMA的蛋白表達水平。
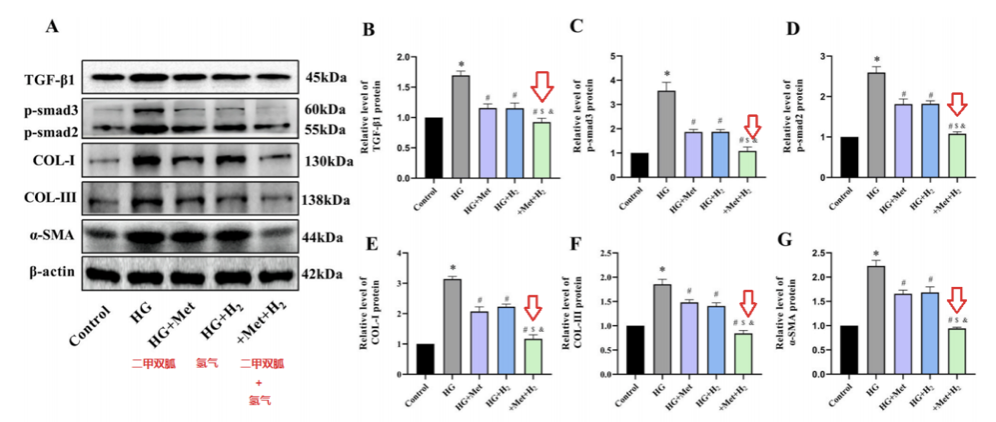
而聯合治療比單一治療,更能減少纖維化相關蛋白的表達。
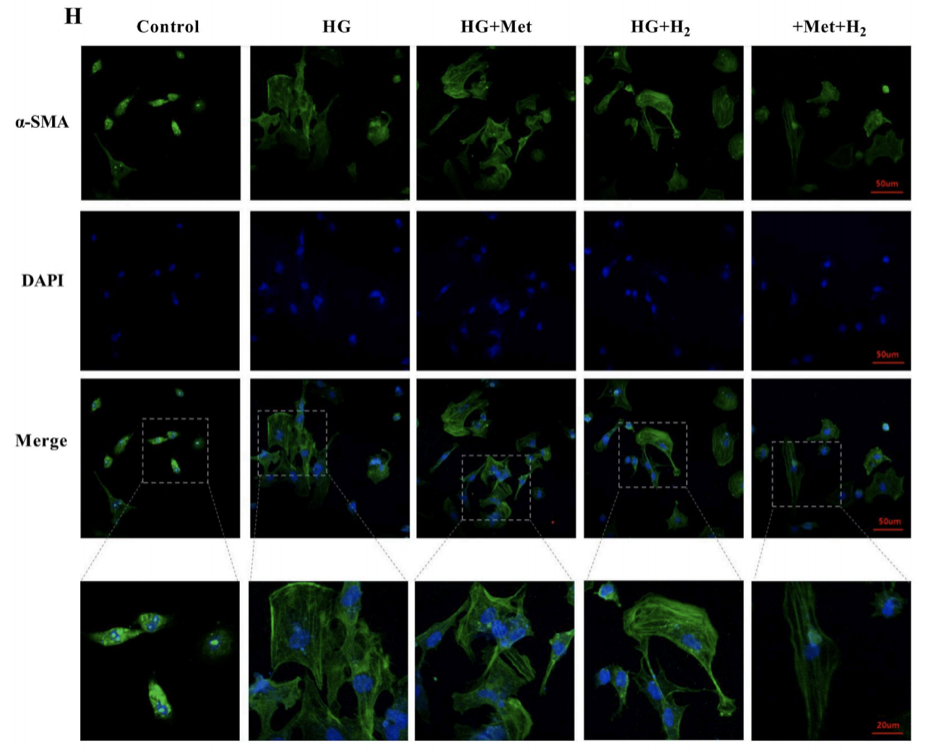
此外,α-SMA的免疫熒光染色檢測,也驗證了上麵的結論。
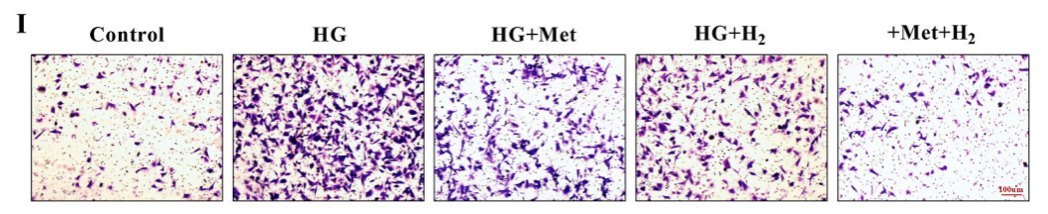
Transwell實驗(細胞體外侵襲實驗)與心髒成纖維細胞(CFs)遷移,表明高血糖增加了CFs遷移能力,而用二甲雙胍或氫氣處理,減輕了CFs遷移能力。值的關注的是這種遷移能力在二甲雙胍和氫氣聯合給藥時達到最低水,表明聯合治療的療效更高。
【結果分析】
研究團隊指出,這是首次證明吸入氫氣可通過抑製細胞焦亡和纖維化,有效減輕糖尿病小鼠的心髒損傷。證據表明,氫氣通過降低AMPK/mTOR/NLRP3信號通路減少細胞焦亡,並通過抑製TGF-β1/Smad信號通路減輕纖維化。
進一步的研究證實,與單獨給藥相比,二甲雙胍和氫氣的共同給藥對糖尿病心髒病(DCM)具有更好的保護作用,表明氫氣可以與二甲雙胍聯合使用以減輕DCM。這些發現為治療糖尿病心髒損傷提供了一種候選策略。
由於衰老、肥胖和糖尿病,心力衰竭的發病率及其相關的發病率和死亡率正以驚人的速度增加。眾所周知,在心力衰竭方麵,糖尿病患者的臨床結果比非糖尿病患者更差【2】。糖尿病的並發症,如擴張型心肌病、糖尿病腎病和糖尿病視網膜病變,對人類的危害最大。
氫氣是繼NO、CO和H2S之後發現的醫用氣體。它具有廣泛的有益特性,包括抗氧化、抗炎、抗細胞凋亡、抗纖維化、抗過敏和能量代謝刺激特性【14、15】。
氫氣改善了糖尿病小鼠的心功能障礙,通過左心室射血分數(EF%)、左心室短軸縮短率(FS%)增加,和腦利鈉肽(BNP)濃度的減少來體現。根據HE和Masson染色檢測,心肌結構異常、肥大表型和膠原蛋白沉積等症狀,通過吸入氫氣而減少。這些數據首次證實了氫在DCM中的心髒保護作用。
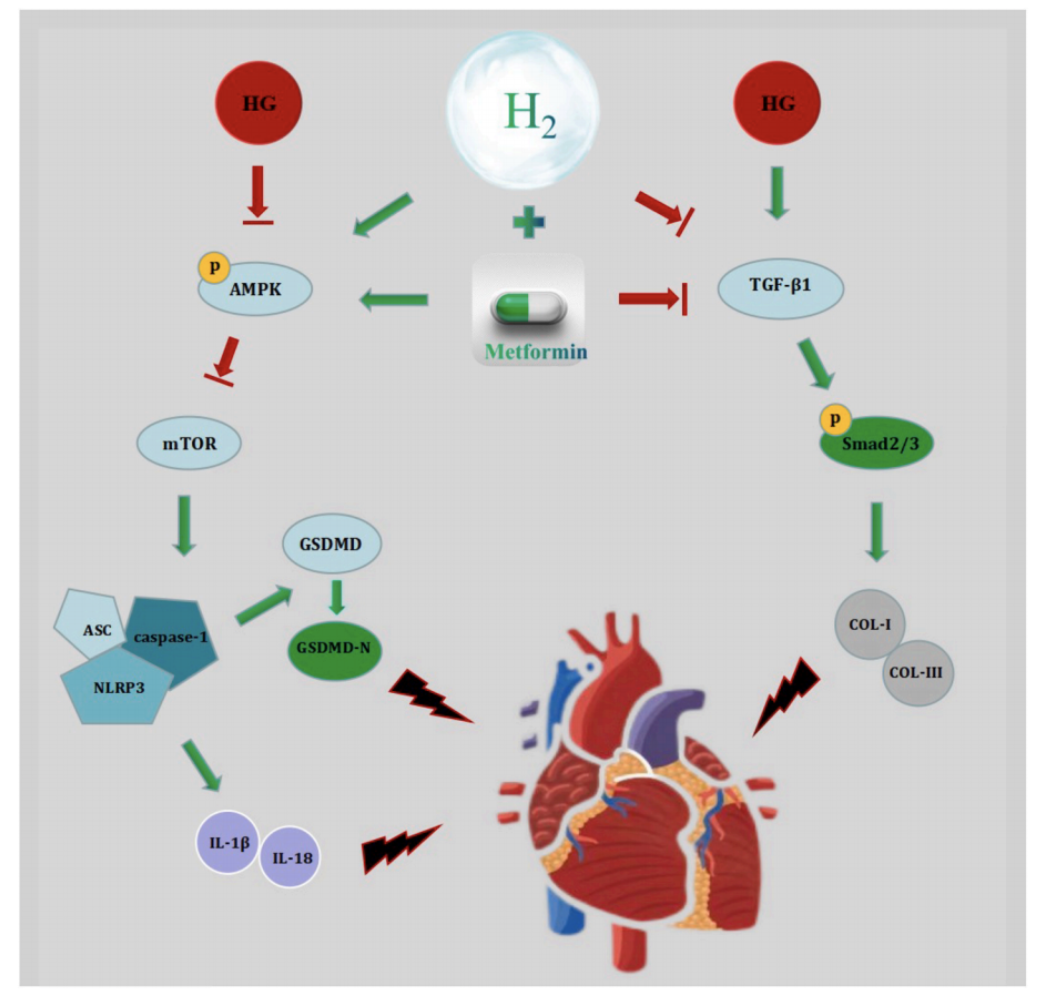
氫氣聯合二甲雙胍,在DCM中發揮心髒保護作用
越來越多的證據表明細胞焦亡會導致DCM的心髒損傷,抑製細胞焦亡可以大大改善預後【8、31、32】。在本研究中,糖尿病小鼠體內細胞焦亡相關蛋白水平(包括NLRP3、cl-Caspase-1、ASC、IL-1β、IL-18和GSDMD-N)顯著升高,而在吸入氫氣後這些指標顯著降低,這與心髒異常形態和心功能障礙的顯著改善有關。蛋白質印跡分析結果顯示,氫氣增加了p-AMPK的表達,逆轉了細胞焦亡相關蛋白的表達,包括NLRP3、GSDMD-N、cl-Caspase- 1、ASC、IL-1β和IL-18,再次驗證了上述實驗結果。這些發現表明,氫氣通過抑製AMPK/mTOR/NLRP3信號通路來減少細胞焦亡。
心肌纖維化是糖尿病的另一個重要病理特征。纖維化歸因於過量的心髒成纖維細胞(CFs)。TGF-β1是心髒纖維化過程的主要執行者,它由CFs產生。研究發現TGF-β1/Smad信號通路在糖尿病小鼠和高血糖環境(HG)處理的CFs中都被激活,TGF-β1、p-smad3、p-smad2、COL-I、COL-III的產生增加證明了這一點。氫抑製了糖尿病小鼠和高血糖環境(HG)處理的CFs中纖維化相關蛋白的表達,說明氫氣通過抑製TGF-β1/Smad信號通路來預防纖維化。
綜上所述,這些結果表明氫在DCM中具有抗焦亡和抗纖維化的特性,這可能為氫如何改善心髒功能障礙和異常形態結構提供解釋。
以往的證據表明,氧化應激與細胞焦亡和纖維化密切相關【33、34】。高血糖引起的過量ROS會破壞線粒體和核DNA,促進DCM的發展【35】。使用抗氧化劑降低糖尿病患者ROS水平,已被證明可以最大限度地減少心肌纖維化並改善心肌收縮功能【36】。氫氣作為一種新型醫用氣體,首先被發現可以減少ROS的形成【13】。考慮到其不同的特性,氫也可能通過減輕氧化還原反應參與保護DCM。
【研究結論】
雖然二甲雙胍在降低糖化血紅蛋白方麵更有效,但副作用,包括胃腸道問題、藥物性皮炎和乳酸性酸中毒,在臨床使用相當長一段時間後變得明顯。二甲雙胍的負麵影響,特別是對患有肝病或腎病的人,限製了它的高劑量使用【22】。為了減少副作用,現在廣泛采用基於二甲雙胍的聯合療法。
在上麵的研究中,與單次給藥相比,二甲雙胍和氫氣的共同給藥進一步降低了糖尿病小鼠的細胞焦亡相關蛋白和纖維化相關蛋白的表達,即使在高血糖環境(HG)下也是如此。氫氣與二甲雙胍具有相似的作用,這已通過免疫組織化學、免疫熒光和transwell測定法得到證實。氫氣和二甲雙胍都可以減少細胞焦亡和纖維化,它們可以在很大程度上平行的途徑上發揮作用。
氫氣可以與二甲雙胍聯合使用,在擴張型心肌病中表現出更強的心髒保護作用。因此,研究團隊建議聯合使用二甲雙胍和氫氣,治療糖尿病心髒病(DCM)。
【參考文獻】
【1】W.H. Dillmann, Diabetic cardiomyopathy, Circ. Res. 124(8)(2019)1160–1162.
【2】G. Jia, M.A. Hill, J.R. Sowers, Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity, Circ. Res. 122(4)(2018)624–638.
【3】Q. Hu, T. Zhang, L. Yi, X. Zhou, M. Mi, Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells, Biofactors 44(2)(2018)123–136.
【4】S.M. Man, R. Karki, T.D. Kanneganti, Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases, Immunol. Rev. 277(1)(2017)61–75.
【5】T.C. Yang, P.Y. Chang, S.C. Lu, L5-LDL from ST-elevation myocardial infarction patients induces IL-1β production via LOX-1 and NLRP3 inflammasome activation in macrophages, Am. J. Physiol. Heart Circ. Physiol. 312(2)(2017)H265–h274.
【6】H. Gonzalez-Pacheco, G. Vargas-Alarcon, J. Angeles-Martinez, C. MartinezSanchez, O. Perez-Mendez, G. Herrera-Maya, M.A. Martinez-Rios, M.A. Pe˜naDuque, C. Posadas-Romero, J.M. Fragoso, The NLRP3 and CASP1 gene polymorphisms are associated with developing of acute coronary syndrome: a casecontrol study, Immunol. Res. 65(4)(2017)862–868.
【7】Z. Qiu, S. Lei, B. Zhao, Y. Wu, W. Su, M. Liu, Q. Meng, B. Zhou, Y. Leng, Z.Y. Xia, NLRP3 inflammasome activation-mediated pyroptosis aggravates myocardial ischemia/reperfusion injury in diabetic rats, Oxid. Med. Cell. Longev.(2017), 9743280, 2017.
【8】B. Luo, B. Li, W. Wang, X. Liu, Y. Xia, C. Zhang, M. Zhang, Y. Zhang, F. An, NLRP3 gene silencing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model, PLoS One 9(8)(2014), e104771.
【9】B. Luo, F. Huang, Y. Liu, Y. Liang, Z. Wei, H. Ke, Z. Zeng, W. Huang, Y. He, NLRP3 inflammasome as a molecular marker in diabetic cardiomyopathy, Front. Physiol. 8(2017)519.
【10】Y.K. Bando, T. Murohara, Diabetes-related heart failure, Circ. J. 78(3)(2014)576–583.
【11】D.C. Rockey, P.D. Bell, J.A. Hill, Fibrosis–a common pathway to organ injury and failure, N. Engl. J. Med. 372(12)(2015)1138–1149.
【12】N.C. Henderson, F. Rieder, T.A. Wynn, Fibrosis: from mechanisms to medicines, Nature 587(7835)(2020)555–566.
【13】I. Ohsawa, M. Ishikawa, K. Takahashi, M. Watanabe, K. Nishimaki, K. Yamagata, K. Katsura, Y. Katayama, S. Asoh, S. Ohta, Hydrogen acts as a therapeuticantioxidant by selectively reducing cytotoxic oxygen radicals, Nat. Med. 13(6)(2007)688–694.
【14】S. Ohta, Recent progress toward hydrogen medicine: potential of molecular hydrogen for preventive and therapeutic applications, Curr. Pharmaceut. Des. 17(22)(2011)2241–2252.
【15】S. Ohta, Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases, Biochim. Biophys. Acta 1820(5)(2012)586–594.
【16】K. Hayashida, M. Sano, I. Ohsawa, K. Shinmura, K. Tamaki, K. Kimura, J. Endo, T. Katayama, A. Kawamura, S. Kohsaka, S. Makino, S. Ohta, S. Ogawa, K. Fukuda, Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury, Biochem. Biophys. Res. Commun. 373(1)(2008)30–35.
【17】B.M. Buchholz, D.J. Kaczorowski, R. Sugimoto, R. Yang, Y. Wang, T.R. Billiar, K. R. McCurry, A.J. Bauer, A. Nakao, Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury, Am. J. Transplant. 8(10)(2008)2015–2024.
【18】T. Kawamura, C.S. Huang, N. Tochigi, S. Lee, N. Shigemura, T.R. Billiar, M. Okumura, A. Nakao, Y. Toyoda, Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats, Transplantation 90(12)(2010)1344–1351.
【19】K. Kohama, H. Yamashita, M. Aoyama-Ishikawa, T. Takahashi, T.R. Billiar, T. Nishimura, J. Kotani, A. Nakao, Hydrogen inhalation protects against acute lung injury induced by hemorrhagic shock and resuscitation, Surgery 158(2)(2015)399–407.
【20】M. Foretz, B. Guigas, L. Bertrand, M. Pollak, B. Viollet, Metformin: from mechanisms of action to therapies, Cell Metabol. 20(6)(2014)953–966.
【21】S. Palee, L. Higgins, T. Leech, S.C. Chattipakorn, N. Chattipakorn, Acute metformin treatment provides cardioprotection via improved mitochondrial function in cardiac ischemia/reperfusion injury, Biomed. Pharmacother. 130(2020)110604.
【22】R. DeFronzo, G.A. Fleming, K. Chen, T.A. Bicsak, Metformin-associated lactic acidosis: current perspectives on causes and risk, Metabolism 65(2)(2016)20–29.
【23】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144(1)(2014)1–11.
【24】P. Fontanari, M. Badier, C. Guillot, C. Tomei, H. Burnet, B. Gardette, Y. Jammes, Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive, Eur. J. Appl. Physiol. 81(4)(2000)325–328.
【25】F. Yang, Y. Qin, Y. Wang, S. Meng, H. Xian, H. Che, J. Lv, Y. Li, Y. Yu, Y. Bai, L. Wang, Metformin inhibits the NLRP3 inflammasome via AMPK/mTORdependent effects in diabetic cardiomyopathy, Int. J. Biol. Sci. 15(5)(2019)1010–1019.
【26】L. Li, W. Luo, Y. Qian, W. Zhu, J. Qian, J. Li, Y. Jin, X. Xu, G. Liang, Luteolin protects against diabetic cardiomyopathy by inhibiting NF-κB-mediated inflammation and activating the Nrf2-mediated antioxidant responses, Phytomedicine 59(2019)152774.
【27】Z. Xie, K. Lau, B. Eby, P. Lozano, C. He, B. Pennington, H. Li, S. Rathi, Y. Dong, R. Tian, D. Kem, M.H. Zou, Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice, Diabetes 60(6)(2011)1770–1778.
【28】Y. Wang, J. Zhang, J. Bo, X. Wang, J. Zhu, Hydrogen-rich saline ameliorated LPSinduced acute lung injury via autophagy inhibition through the ROS/AMPK/mTOR pathway in mice, Exp. Biol. Med. 244(9)(2019)721–727.
【29】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144(1)(2014)1–11.
【30】J. Bai, N. Zhang, Y. Hua, B. Wang, L. Ling, A. Ferro, B. Xu, Metformin inhibits angiotensin II-induced differentiation of cardiac fibroblasts into myofibroblasts, PLoS One 8(9)(2013), e72120.
【31】Y. Zhang, X. Liu, X. Bai, Y. Lin, Z. Li, J. Fu, M. Li, T. Zhao, H. Yang, R. Xu, J. Li, J. Ju, B. Cai, C. Xu, B. Yang, Melatonin prevents endothelial cell pyroptosis via regulation of long noncoding RNA MEG3/miR-223/NLRP3 axis, J. Pineal Res. 64(2)(2018).
【32】Yang, F.; Qin, Y.; Wang, Y.; Li, A.; Lv, J.; Sun, X.; Che, H.; Han, T.; Meng, S.; Bai, Y.; Wang, L., LncRNA KCNQ1OT1 mediates pyroptosis in diabetic cardiomyopathy. Cell. Physiol. Biochem. : international journal of experimental cellular physiology, biochemistry, and pharmacology 2018, 50(4), 1230-1244.
【33】M.Y. Li, X.L. Zhu, B.X. Zhao, L. Shi, W. Wang, W. Hu, S.L. Qin, B.H. Chen, P. H. Zhou, B. Qiu, Y. Gao, B.L. Liu, Adrenomedullin alleviates the pyroptosis of Leydig cells by promoting autophagy via the ROS-AMPK-mTOR axis, Cell Death Dis 10(7)(2019)489.
【34】W. Zhu, R.D. Wu, Y.G. Lv, Y.M. Liu, H. Huang, J.Q. Xu, BRD4 blockage alleviates pathological cardiac hypertrophy through the suppression of fibrosis and inflammation via reducing ROS generation, Biomed. Pharmacother. 121(2020)109368.
【35】H. Bugger, C. Bode, The vulnerable myocardium. Diabetic cardiomyopathy, H¨amostaseologie 35(1)(2015)17–24.
【36】T. Fukai, M. Ushio-Fukai, Superoxide dismutases: role in redox signaling, vascular function, and diseases, Antioxidants Redox Signal. 15(6)(2011)1583–1606.【背景介紹】
糖尿病會引起多種並發症,在中老年人群中,糖尿病心髒病是糖尿病患者致死的主要原因之一,尤其是在2型糖尿病患者中。
廣義的糖尿病心髒病包括冠狀動脈粥樣硬化性心髒病(冠心病),糖尿病心肌病和糖尿病心髒自主神經病變等。糖尿病心髒病與非糖尿病患者相比,常起病比較早,糖尿病患者伴冠心病常表現為無痛性心肌梗死,梗死麵積比較大,穿壁梗死多,病情多比較嚴重,預後比較差,病死率較高;如冠狀動脈造影和臨床排除冠狀動脈病變,糖尿病患者出現嚴重的心律失常、心髒肥大、肺淤血和充血性心力衰竭,尤其是難治性心力衰竭,臨床可考慮糖尿病心肌病。
其中,糖尿病性心肌病(DCM)是比較有代表性的疾病。由於它隻發生於糖尿病的患者,不能夠用高血壓性心髒病、冠狀動脈粥樣硬化性心髒病以及其他心髒病變來解釋的心肌疾病這種情況。
它是由於在代謝紊亂、以及微血管病變的基礎上會發生廣泛的局灶性的心肌壞死,產生的病因和心肌細胞代謝紊亂,心肌細胞的鈣轉運缺陷有一定關係【1】。如果治療不當,心髒纖維化和肥大會導致心力衰竭甚至死亡【2】。
【發病機製】
細胞焦亡(細胞炎性壞死)是一種在炎症存在下發生的程序性細胞死亡【3】,其特征是細胞持續增大直至細胞膜破裂,從而引發明顯的炎症反應。為了應對不同類型的刺激(如高血糖環境),細胞會產出各種NRL受體,如NLRP3炎性小體。然後激活裂解caspase-1(cl-Caspase-1,一種蛋白水解酶)。cl-Caspase-1裂解成孔細胞死亡執行因子gasdermin-D(GSDMD),GSDMD易位至膜形成孔,導致白細胞介素(IL)-18和IL-1β的釋放【3、4】。
細胞焦亡涉及多種心血管疾病,例如心肌梗死【5、6】、缺血再灌注損傷【7】,和心肌病【8、9】等。所有這些研究表明,尋找一種針對DCM細胞焦亡的幹預措施,是預防和治療糖尿病性心肌病的有效途徑。
DCM的另一種發病機製是纖維化,以心室重構為主要標誌,導致心室壁僵硬和舒張功能障礙,最終誘發心力衰竭。高胰島素血症和高血糖會刺激DCM中腎素血管緊張素-醛固酮通路的激活,從而導致轉化生長因子-β1(TGF-β1)的激活【10】。
TGF-β1是一種促纖維化細胞因子,可使Smad磷酸化。因此,TGF-β1/Smad信號通路充當下遊效應器,修飾靶基因表達並最終導致心髒纖維化和收縮/舒張功能障礙【11】. TGF-β1已成為抗纖維化治療最重要的靶點之一【12】,對延緩病情進展,減少心力衰竭的發生具有重要意義。
因此,尋找能夠選擇性抑製細胞焦亡、纖維化的有效幹預措施,對於預防DCM具有重要的臨床意義。
【氫氣用於DCM治療的可行性分析】
氫氣通過選擇性地減少細胞氧自由基,特別是最有害的活性氧(ROS),起到治療性抗氧化劑的作用【13】。近年來,氫氣已被證明具有抗炎、抗氧化和抗纖維化的特性【14、15】。越來越多的證據表明,氫氣對缺血性心髒病有效【16】、小腸和肺的缺血再灌注損傷【17、18】,失血性休克【19】。
二甲雙胍作為時下治療糖尿病的一線藥物【20】,已被證明具有降血糖作用和心髒保護作用【21】。但是,肝腎功能不全限製了它的高劑量使用【22】。氫氣吸入具有多種作用機製,無副作用、安全且易於使用【23、24】,因此,氫聯合二甲雙胍可能是一種新的治療策略。
【研究實驗】
來自中國哈爾濱醫科大學第四附屬醫院心內科、檢驗科的團隊,進行了這方麵的研究,其成果發表在《Free Radical Biology and Medicine》上麵。
實驗選用4周齡雄性C57BL/6小鼠,將小鼠隨機分為五組:分別為對照組(n = 10)、糖尿病組(DM,n = 10)、吸入氫氣治療組(DM + H2,n = 10)、二甲雙胍治療組(DM + Met , n = 10)和用二甲雙胍和氫氣治療組(DM+Met+H2,n=10)。所有小鼠都在標準條件下被圈養和適應環境,並喂食正常食物直至研究結束。
然後,為糖尿病組小鼠建立糖尿病模型(血糖值≥16.7 mmol/L證實糖尿病模型建立成功)【25,26】。接下來,各組按下列方式進行治療。吸入氫氣治療組,每天吸入2%氫氣3小時;二甲雙胍治療組,在飲用水中加入二甲雙胍(200 mg/kg/d,Sigma)【25、27】;二甲雙胍和氫氣治療組,接受氫氣和二甲雙胍聯合治療。所有小鼠飼養8周,之後進行相關檢測。
【實驗結果】
實驗結果一:氫氣改善了糖尿病小鼠的心功能障礙和異常形態結構
研究團隊通過超聲心動圖用於評估心髒功能的變化。糖尿病組小鼠有明顯的心髒收縮和舒張功能障礙,這種改變在氫氣指治療組中大大減少。

這些變化顯示在左心室射血分數(EF%)、左心室短軸縮短率(FS%)、舒張末期左心室內徑(LVIDd)和收縮末期左心室內徑(LVIDs)的數據對比中。

糖尿病組小鼠的心肌表現出嚴重的肌節紊亂和線粒體(M)腫脹,這在對照組中未見,氫氣治療組的肌節紊亂和線粒體腫脹明顯減少。

糖尿病組的腦利鈉肽(BNP)濃度顯著升高,這種變化在氫氣治療組中被逆轉。綜上所述,這些數據表明氫氣可以減輕心髒功能障礙和異常。
結果二:氫氣可降低糖尿病小鼠NLRP3介導的細胞焦亡蛋白的表達
為了確定氫對糖尿病小鼠細胞焦亡的療效,研究團隊觀察了細胞焦亡相關的蛋白質水平。

結果發現,NLRP3、cl-Caspase-1、ASC、IL-18、IL-1β和GSDMD-N水平在糖尿病組小鼠中升高;而氫氣吸入治療,有效地恢複了這些炎症細胞因子水平。

另外,與糖尿病組小鼠比較,氫氣治療組小鼠NLRP3、cl-Caspase-1和IL-1β水平較低。以上結果說明氫氣可以減少糖尿病小鼠的心髒NLRP3相關細胞焦亡。
結果三:氫氣可降低糖尿病小鼠TGF-β1介導的纖維化蛋白的表達
過度心肌纖維化是擴張型心肌病的另一個重要特征,給治療帶來困難。TGF-β1/Smad信號通路在心肌纖維化進程中起著至關重要的作用【10、11】。為了驗證氫氣對糖尿病小鼠心肌纖維化的療效,研究團隊觀察了纖維化相關蛋白水平。

與對照組相比,糖尿病組小鼠的TGF-β1、p-smad3、p-smad2、COL-I、COL-III和α-SMA水平顯著升高,而這些蛋白水平在經過吸入氫氣治療後顯著降低。

免疫組織化學染色測試,也證明了這些發現,表明氫氣吸入降低了糖尿病組組中TGF-β1、COL-I和COL-III的水平。以上結果表明氫氣可以減輕糖尿病小鼠的心髒纖維化。
結果四:在高血糖(HG)條件下吸入氫氣,通過減少AMPK/ mTOR/NLRP3信號通路抑製細胞焦亡
在確認氫在減輕糖尿病小鼠細胞焦亡中的作用後,下一步是闡明其潛在機製。既往研究證實,富氫鹽水可通過AMPK/mTOR信號通路減少內毒素引起的急性肺損傷【28】,二甲雙胍通過AMPK/mTOR途徑減輕【25】糖尿病。推測氫也可能通過介導糖尿病組中的AMPK/mTOR/NLRP3通路來抑製細胞焦亡。
為了更好地理解氫、AMPK和NLRP3之間的相互作用,研究團隊提取了原代心肌細胞,並在用氫幹預高糖環境(標記為HG+H2)和不用氫幹預的高糖環境(標記為HG)處理的5.0 mmol/L(對照)和30 mmol/L葡萄糖中生長。Compound C(標記為CC)是一種選擇性,ATP競爭性的AMPK抑製劑,被證明可加重高葡萄糖誘導的細胞損傷,並充當阻斷劑,采用氫幹預高糖環境,添加Compound C(標記為HG+H2+CC)對高糖處理的心肌細胞進行給藥處理。

采用Hoechst33342/PI雙熒光染色檢測高糖誘導的細胞死亡,結果顯示高糖誘導的原代心肌細胞死亡增加被氫氣逆轉,而這種保護作用被CC幹預破壞。

通過CCK8測定和LDH釋放測定,檢測心肌細胞的活性和損傷程度,結果與Hoechst33342/PI雙熒光染色的結果一致,表明CC破壞了氫的保護作用。

隨後,經過Western blot檢測,顯示HG組的p-AMPK水平降低。經過氫氣治療後HG+H2組mTOR、IL-18、IL-1β、cl-Caspase-1、ASC、GSDMD-N和NLRP3的水平顯著低於HG組;這種保護作用被CC破壞了(HG+H2+CC)。這些發現表明氫通過AMPK/mTOR/NLRP3軸抑製細胞焦亡。
結果五:高糖環境下吸入氫氣,通過抑製TGF-β1/Smad通路減輕纖維化
在確認氫氣減輕糖尿病小鼠的心肌纖維化以及氫氣降低TGF-β1、p-smad3和p-smad2的水平後,研究團體探索氫氣與TGF-β1的關係。
取心髒成纖維細胞,並在用氫幹預高糖環境(HG + H2)或不用氫氣幹預的高糖環境(HG),處理的5.5 mmol/L(對照)和30 mmol/L葡萄糖溶液中培養;將外源性TGF-β1於用氫氣幹預的高糖環境中(標記為HG + H2+TGF-β1)。

根據蛋白質印跡,TGF-β1、p-smad3、p-smad2、COL-I、COL-III和α-SMA水平在不用氫氣幹預的高糖環境中顯著更高;經過氫幹預高糖環境(HG + H2)處理後,水平顯著降低;在添加了外源性TGF-β1,氫氣的保護作用被破壞。

TGF-β1的免疫熒光檢測證實了這一發現
心髒成纖維細胞(CFs)遷移是病理性纖維化的另一個原因。Transwell(用於檢測細胞遷移)用於評估氫氣對CFs遷移的影響。

結果表明,在不用氫氣幹預的高糖環境中(HG)增加了CFs在心底中的遷移,氫氣幹預(HG+H2)有效地阻止了遷移,但這種保護作用,被外源性TGFβ1破壞。
結果六:二甲雙胍+氫氣治療抑製糖尿病引起的小鼠組織病理學改變
盡管二甲雙胍是一線藥物,但由於擔心副作用風險增加,在肝腎功能不全患者中大劑量使用曆來是禁忌的【22】。氫氣是一種生理惰性氣體,不會與任何活性化合物發生反應【29】,非常易於使用。接下來,研究團隊分析了糖尿病小鼠對二甲雙胍和氫氣聯合給藥的反應。
實驗人員將小鼠分為5組,對照組(n = 20)、糖尿病組(DM,n = 20)、吸入氫氣治療組(DM + H2,n = 20)、二甲雙胍治療組(DM + Met , n = 20)和用二甲雙胍和氫氣治療組(DM+Met+H2,n=20)。2個月後,各組存活數量依次為20、10、14、13、17。

二甲雙胍和氫氣處理均提高了小鼠的存活率,而二甲雙胍和氫氣聯合給藥表現出更顯著的保護作用,另外,單獨使用二甲雙胍(DM + Met)或與氫氣聯合使用(DM + Met + H2)可顯著降低空腹血糖水平。與DM組相比,DM+H2組空腹血糖水平略有降低。


左心室射血分數(EF%)、左心室短軸縮短率(FS%)增加,舒張末期左心室內徑(LVIDd)和收縮末期左心室內徑(LVIDs)減少,表明氫氣聯合二甲雙胍治療,比單一治療發揮更顯著的效果。
HE染色(蘇木精-伊紅染色法)顯示糖尿病組心肌結構異常、肥厚,單次服用二甲雙胍或氫氣可減輕這種心肌結構異常、肥大,而同時聯合服用二甲雙胍和氫氣效果更顯著。

Masson染色(固綠法)顯示DM+Met+H2組間質纖維化程度低於單一治療組。此外,透射電子顯微鏡顯示,糖尿病組肌節(肌原纖維節,是肌原纖維的基本單位)紊亂、線粒體腫脹、細胞核固縮;而在DM+Met、DM+H2組中,這種問題得到緩解;在DM+Met+H2組中,肌節紊亂、線粒體腫脹、核固縮等損傷幾乎完全消除。
結果七:與單獨幹預相比,二甲雙胍聯合氫氣幹預,減少了糖尿病小鼠的細胞焦亡和纖維化
氫氣抑製糖尿病小鼠模型中的細胞焦亡和纖維化,二甲雙胍已被證明具有抗細胞焦亡和抗纖維化特性【25、30】。研究團隊通過蛋白質印跡和免疫組織化學測定蛋白質,評估二甲雙胍和氫氣聯合給藥對糖尿病小鼠細胞焦亡相關蛋白和纖維化相關蛋白表達的影響。

二甲雙胍和氫均降低了NLRP3、cl-Caspase-1和IL-1β的表達,而聯合治療更顯著降低了蛋白質表達水平。

Western blot檢測,也發現DM + Met+ H2組的TGF-β1、p-smad3、p-smad2和α-SMA水平,低於DM+H2和DM+Met組。

此外,免疫組織化學檢測,也證實了類似的現象。這些結果表明,與單獨給藥相比,二甲雙胍和氫氣的共同給藥,對DCM顯示出更好的抗細胞焦亡和抗纖維化作用。
結果八:在高血糖(HG)環境下,二甲雙胍聯合氫氣幹預,進一步減輕了細胞損傷。
根據cck-8檢測(細胞增殖毒性檢測),高血糖會顯著降低心肌細胞的活性。

二甲雙胍和氫氣都增加了暴露於高血糖的心肌細胞的活性,而二甲雙胍和氫氣的共同給藥,提供了更好的保護作用(圖A);LDH釋放試驗結果也驗證了上麵的結論(圖B)。
蛋白質印跡分析的結果表明,高血糖上調了細胞焦亡相關蛋白,包括IL-1β、cl-Caspase-1、ASC和NLRP3。

而二甲雙胍和氫氣的共同給藥組的的蛋白表達水平,顯著低於單一治療組。這些數據表明,二甲雙胍和氫氣的共同給藥可以減少高血糖條件下的細胞焦亡,從而最大限度地減少細胞損傷。
結果九:在高血糖環境下,二甲雙胍聯合氫氣幹預,進一步緩解了纖維化。
Western blot檢測發現,高血糖環境增加了纖維化相關蛋白TGF-β1、p-smad3、p-smad2、COL-I、COL-III、α- SMA的蛋白表達水平。

而聯合治療比單一治療,更能減少纖維化相關蛋白的表達。

此外,α-SMA的免疫熒光染色檢測,也驗證了上麵的結論。

Transwell實驗(細胞體外侵襲實驗)與心髒成纖維細胞(CFs)遷移,表明高血糖增加了CFs遷移能力,而用二甲雙胍或氫氣處理,減輕了CFs遷移能力。值的關注的是這種遷移能力在二甲雙胍和氫氣聯合給藥時達到最低水,表明聯合治療的療效更高。
【結果分析】
研究團隊指出,這是首次證明吸入氫氣可通過抑製細胞焦亡和纖維化,有效減輕糖尿病小鼠的心髒損傷。證據表明,氫氣通過降低AMPK/mTOR/NLRP3信號通路減少細胞焦亡,並通過抑製TGF-β1/Smad信號通路減輕纖維化。
進一步的研究證實,與單獨給藥相比,二甲雙胍和氫氣的共同給藥對糖尿病心髒病(DCM)具有更好的保護作用,表明氫氣可以與二甲雙胍聯合使用以減輕DCM。這些發現為治療糖尿病心髒損傷提供了一種候選策略。
由於衰老、肥胖和糖尿病,心力衰竭的發病率及其相關的發病率和死亡率正以驚人的速度增加。眾所周知,在心力衰竭方麵,糖尿病患者的臨床結果比非糖尿病患者更差【2】。糖尿病的並發症,如擴張型心肌病、糖尿病腎病和糖尿病視網膜病變,對人類的危害最大。
氫氣是繼NO、CO和H2S之後發現的醫用氣體。它具有廣泛的有益特性,包括抗氧化、抗炎、抗細胞凋亡、抗纖維化、抗過敏和能量代謝刺激特性【14、15】。
氫氣改善了糖尿病小鼠的心功能障礙,通過左心室射血分數(EF%)、左心室短軸縮短率(FS%)增加,和腦利鈉肽(BNP)濃度的減少來體現。根據HE和Masson染色檢測,心肌結構異常、肥大表型和膠原蛋白沉積等症狀,通過吸入氫氣而減少。這些數據首次證實了氫在DCM中的心髒保護作用。

氫氣聯合二甲雙胍,在DCM中發揮心髒保護作用
越來越多的證據表明細胞焦亡會導致DCM的心髒損傷,抑製細胞焦亡可以大大改善預後【8、31、32】。在本研究中,糖尿病小鼠體內細胞焦亡相關蛋白水平(包括NLRP3、cl-Caspase-1、ASC、IL-1β、IL-18和GSDMD-N)顯著升高,而在吸入氫氣後這些指標顯著降低,這與心髒異常形態和心功能障礙的顯著改善有關。蛋白質印跡分析結果顯示,氫氣增加了p-AMPK的表達,逆轉了細胞焦亡相關蛋白的表達,包括NLRP3、GSDMD-N、cl-Caspase- 1、ASC、IL-1β和IL-18,再次驗證了上述實驗結果。這些發現表明,氫氣通過抑製AMPK/mTOR/NLRP3信號通路來減少細胞焦亡。
心肌纖維化是糖尿病的另一個重要病理特征。纖維化歸因於過量的心髒成纖維細胞(CFs)。TGF-β1是心髒纖維化過程的主要執行者,它由CFs產生。研究發現TGF-β1/Smad信號通路在糖尿病小鼠和高血糖環境(HG)處理的CFs中都被激活,TGF-β1、p-smad3、p-smad2、COL-I、COL-III的產生增加證明了這一點。氫抑製了糖尿病小鼠和高血糖環境(HG)處理的CFs中纖維化相關蛋白的表達,說明氫氣通過抑製TGF-β1/Smad信號通路來預防纖維化。
綜上所述,這些結果表明氫在DCM中具有抗焦亡和抗纖維化的特性,這可能為氫如何改善心髒功能障礙和異常形態結構提供解釋。
以往的證據表明,氧化應激與細胞焦亡和纖維化密切相關【33、34】。高血糖引起的過量ROS會破壞線粒體和核DNA,促進DCM的發展【35】。使用抗氧化劑降低糖尿病患者ROS水平,已被證明可以最大限度地減少心肌纖維化並改善心肌收縮功能【36】。氫氣作為一種新型醫用氣體,首先被發現可以減少ROS的形成【13】。考慮到其不同的特性,氫也可能通過減輕氧化還原反應參與保護DCM。
【研究結論】
雖然二甲雙胍在降低糖化血紅蛋白方麵更有效,但副作用,包括胃腸道問題、藥物性皮炎和乳酸性酸中毒,在臨床使用相當長一段時間後變得明顯。二甲雙胍的負麵影響,特別是對患有肝病或腎病的人,限製了它的高劑量使用【22】。為了減少副作用,現在廣泛采用基於二甲雙胍的聯合療法。
在上麵的研究中,與單次給藥相比,二甲雙胍和氫氣的共同給藥進一步降低了糖尿病小鼠的細胞焦亡相關蛋白和纖維化相關蛋白的表達,即使在高血糖環境(HG)下也是如此。氫氣與二甲雙胍具有相似的作用,這已通過免疫組織化學、免疫熒光和transwell測定法得到證實。氫氣和二甲雙胍都可以減少細胞焦亡和纖維化,它們可以在很大程度上平行的途徑上發揮作用。
氫氣可以與二甲雙胍聯合使用,在擴張型心肌病中表現出更強的心髒保護作用。因此,研究團隊建議聯合使用二甲雙胍和氫氣,治療糖尿病心髒病(DCM)。
【參考文獻】
【1】W.H. Dillmann, Diabetic cardiomyopathy, Circ. Res. 124(8)(2019)1160–1162.
【2】G. Jia, M.A. Hill, J.R. Sowers, Diabetic cardiomyopathy: an update of mechanisms contributing to this clinical entity, Circ. Res. 122(4)(2018)624–638.
【3】Q. Hu, T. Zhang, L. Yi, X. Zhou, M. Mi, Dihydromyricetin inhibits NLRP3 inflammasome-dependent pyroptosis by activating the Nrf2 signaling pathway in vascular endothelial cells, Biofactors 44(2)(2018)123–136.
【4】S.M. Man, R. Karki, T.D. Kanneganti, Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases, Immunol. Rev. 277(1)(2017)61–75.
【5】T.C. Yang, P.Y. Chang, S.C. Lu, L5-LDL from ST-elevation myocardial infarction patients induces IL-1β production via LOX-1 and NLRP3 inflammasome activation in macrophages, Am. J. Physiol. Heart Circ. Physiol. 312(2)(2017)H265–h274.
【6】H. Gonzalez-Pacheco, G. Vargas-Alarcon, J. Angeles-Martinez, C. MartinezSanchez, O. Perez-Mendez, G. Herrera-Maya, M.A. Martinez-Rios, M.A. Pe˜naDuque, C. Posadas-Romero, J.M. Fragoso, The NLRP3 and CASP1 gene polymorphisms are associated with developing of acute coronary syndrome: a casecontrol study, Immunol. Res. 65(4)(2017)862–868.
【7】Z. Qiu, S. Lei, B. Zhao, Y. Wu, W. Su, M. Liu, Q. Meng, B. Zhou, Y. Leng, Z.Y. Xia, NLRP3 inflammasome activation-mediated pyroptosis aggravates myocardial ischemia/reperfusion injury in diabetic rats, Oxid. Med. Cell. Longev.(2017), 9743280, 2017.
【8】B. Luo, B. Li, W. Wang, X. Liu, Y. Xia, C. Zhang, M. Zhang, Y. Zhang, F. An, NLRP3 gene silencing ameliorates diabetic cardiomyopathy in a type 2 diabetes rat model, PLoS One 9(8)(2014), e104771.
【9】B. Luo, F. Huang, Y. Liu, Y. Liang, Z. Wei, H. Ke, Z. Zeng, W. Huang, Y. He, NLRP3 inflammasome as a molecular marker in diabetic cardiomyopathy, Front. Physiol. 8(2017)519.
【10】Y.K. Bando, T. Murohara, Diabetes-related heart failure, Circ. J. 78(3)(2014)576–583.
【11】D.C. Rockey, P.D. Bell, J.A. Hill, Fibrosis–a common pathway to organ injury and failure, N. Engl. J. Med. 372(12)(2015)1138–1149.
【12】N.C. Henderson, F. Rieder, T.A. Wynn, Fibrosis: from mechanisms to medicines, Nature 587(7835)(2020)555–566.
【13】I. Ohsawa, M. Ishikawa, K. Takahashi, M. Watanabe, K. Nishimaki, K. Yamagata, K. Katsura, Y. Katayama, S. Asoh, S. Ohta, Hydrogen acts as a therapeuticantioxidant by selectively reducing cytotoxic oxygen radicals, Nat. Med. 13(6)(2007)688–694.
【14】S. Ohta, Recent progress toward hydrogen medicine: potential of molecular hydrogen for preventive and therapeutic applications, Curr. Pharmaceut. Des. 17(22)(2011)2241–2252.
【15】S. Ohta, Molecular hydrogen is a novel antioxidant to efficiently reduce oxidative stress with potential for the improvement of mitochondrial diseases, Biochim. Biophys. Acta 1820(5)(2012)586–594.
【16】K. Hayashida, M. Sano, I. Ohsawa, K. Shinmura, K. Tamaki, K. Kimura, J. Endo, T. Katayama, A. Kawamura, S. Kohsaka, S. Makino, S. Ohta, S. Ogawa, K. Fukuda, Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury, Biochem. Biophys. Res. Commun. 373(1)(2008)30–35.
【17】B.M. Buchholz, D.J. Kaczorowski, R. Sugimoto, R. Yang, Y. Wang, T.R. Billiar, K. R. McCurry, A.J. Bauer, A. Nakao, Hydrogen inhalation ameliorates oxidative stress in transplantation induced intestinal graft injury, Am. J. Transplant. 8(10)(2008)2015–2024.
【18】T. Kawamura, C.S. Huang, N. Tochigi, S. Lee, N. Shigemura, T.R. Billiar, M. Okumura, A. Nakao, Y. Toyoda, Inhaled hydrogen gas therapy for prevention of lung transplant-induced ischemia/reperfusion injury in rats, Transplantation 90(12)(2010)1344–1351.
【19】K. Kohama, H. Yamashita, M. Aoyama-Ishikawa, T. Takahashi, T.R. Billiar, T. Nishimura, J. Kotani, A. Nakao, Hydrogen inhalation protects against acute lung injury induced by hemorrhagic shock and resuscitation, Surgery 158(2)(2015)399–407.
【20】M. Foretz, B. Guigas, L. Bertrand, M. Pollak, B. Viollet, Metformin: from mechanisms of action to therapies, Cell Metabol. 20(6)(2014)953–966.
【21】S. Palee, L. Higgins, T. Leech, S.C. Chattipakorn, N. Chattipakorn, Acute metformin treatment provides cardioprotection via improved mitochondrial function in cardiac ischemia/reperfusion injury, Biomed. Pharmacother. 130(2020)110604.
【22】R. DeFronzo, G.A. Fleming, K. Chen, T.A. Bicsak, Metformin-associated lactic acidosis: current perspectives on causes and risk, Metabolism 65(2)(2016)20–29.
【23】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144(1)(2014)1–11.
【24】P. Fontanari, M. Badier, C. Guillot, C. Tomei, H. Burnet, B. Gardette, Y. Jammes, Changes in maximal performance of inspiratory and skeletal muscles during and after the 7.1-MPa Hydra 10 record human dive, Eur. J. Appl. Physiol. 81(4)(2000)325–328.
【25】F. Yang, Y. Qin, Y. Wang, S. Meng, H. Xian, H. Che, J. Lv, Y. Li, Y. Yu, Y. Bai, L. Wang, Metformin inhibits the NLRP3 inflammasome via AMPK/mTORdependent effects in diabetic cardiomyopathy, Int. J. Biol. Sci. 15(5)(2019)1010–1019.
【26】L. Li, W. Luo, Y. Qian, W. Zhu, J. Qian, J. Li, Y. Jin, X. Xu, G. Liang, Luteolin protects against diabetic cardiomyopathy by inhibiting NF-κB-mediated inflammation and activating the Nrf2-mediated antioxidant responses, Phytomedicine 59(2019)152774.
【27】Z. Xie, K. Lau, B. Eby, P. Lozano, C. He, B. Pennington, H. Li, S. Rathi, Y. Dong, R. Tian, D. Kem, M.H. Zou, Improvement of cardiac functions by chronic metformin treatment is associated with enhanced cardiac autophagy in diabetic OVE26 mice, Diabetes 60(6)(2011)1770–1778.
【28】Y. Wang, J. Zhang, J. Bo, X. Wang, J. Zhu, Hydrogen-rich saline ameliorated LPSinduced acute lung injury via autophagy inhibition through the ROS/AMPK/mTOR pathway in mice, Exp. Biol. Med. 244(9)(2019)721–727.
【29】S. Ohta, Molecular hydrogen as a preventive and therapeutic medical gas: initiation, development and potential of hydrogen medicine, Pharmacol. Therapeutic. 144(1)(2014)1–11.
【30】J. Bai, N. Zhang, Y. Hua, B. Wang, L. Ling, A. Ferro, B. Xu, Metformin inhibits angiotensin II-induced differentiation of cardiac fibroblasts into myofibroblasts, PLoS One 8(9)(2013), e72120.
【31】Y. Zhang, X. Liu, X. Bai, Y. Lin, Z. Li, J. Fu, M. Li, T. Zhao, H. Yang, R. Xu, J. Li, J. Ju, B. Cai, C. Xu, B. Yang, Melatonin prevents endothelial cell pyroptosis via regulation of long noncoding RNA MEG3/miR-223/NLRP3 axis, J. Pineal Res. 64(2)(2018).
【32】Yang, F.; Qin, Y.; Wang, Y.; Li, A.; Lv, J.; Sun, X.; Che, H.; Han, T.; Meng, S.; Bai, Y.; Wang, L., LncRNA KCNQ1OT1 mediates pyroptosis in diabetic cardiomyopathy. Cell. Physiol. Biochem. : international journal of experimental cellular physiology, biochemistry, and pharmacology 2018, 50(4), 1230-1244.
【33】M.Y. Li, X.L. Zhu, B.X. Zhao, L. Shi, W. Wang, W. Hu, S.L. Qin, B.H. Chen, P. H. Zhou, B. Qiu, Y. Gao, B.L. Liu, Adrenomedullin alleviates the pyroptosis of Leydig cells by promoting autophagy via the ROS-AMPK-mTOR axis, Cell Death Dis 10(7)(2019)489.
【34】W. Zhu, R.D. Wu, Y.G. Lv, Y.M. Liu, H. Huang, J.Q. Xu, BRD4 blockage alleviates pathological cardiac hypertrophy through the suppression of fibrosis and inflammation via reducing ROS generation, Biomed. Pharmacother. 121(2020)109368.
【35】H. Bugger, C. Bode, The vulnerable myocardium. Diabetic cardiomyopathy, H¨amostaseologie 35(1)(2015)17–24.
【36】T. Fukai, M. Ushio-Fukai, Superoxide dismutases: role in redox signaling, vascular function, and diseases, Antioxidants Redox Signal. 15(6)(2011)1583–1606.
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號