細胞焦亡作為機體重要的天然免疫反應,在拮抗和清除病原菌感染中發揮關鍵作用。當革蘭氏陰性菌侵入宿主細胞後,其外膜的重要病原分子模式LPS(脂多糖,也稱內毒素)會被宿主細胞內的天然免疫受體caspase-4/5/11識別,LPS激活的caspase-4/5/11會進一步切割活化焦亡蛋白GSDMD釋放其膜打孔活性,導致細胞焦亡,激發宿主的抗菌炎症反應。同時,細菌也采用了多種策略來逃避宿主的免疫防禦,例
細胞焦亡作為機體重要的天然免疫反應,在拮抗和清除病原菌感染中發揮關鍵作用。當革蘭氏陰性菌侵入宿主細胞後,其外膜的重要病原分子模式LPS(脂多糖,也稱內毒素)會被宿主細胞內的天然免疫受體caspase-4/5/11識別,LPS激活的caspase-4/5/11會進一步切割活化焦亡蛋白GSDMD釋放其膜打孔活性,導致細胞焦亡,激發宿主的抗菌炎症反應。同時,細菌也采用了多種策略來逃避宿主的免疫防禦,例如通過獨特的III型分泌係統向宿主細胞“注入”專門的效應蛋白,幹擾宿主的免疫防禦通路。2021年,北京生命科學研究所邵峰團隊發現痢疾杆菌(Shigella)分泌的效應蛋白OspC3可以特異識別宿主細胞內的天然免疫受體caspase-4/11,通過催化caspase酶活中心的關鍵精氨酸發生一種全新的ADP-riboxanation翻譯後修飾使caspase-4/11失活,阻斷其活化下遊GSDMD介導的細胞焦亡免疫防禦。然而效應蛋白OspC3是如何特異地識別宿主靶標caspase-4/11,又是如何催化新穎的ADP-riboxanation修飾拮抗細胞焦亡的精確分子機理等關鍵科學問題有待進一步回答。
近日,中國科學院生物物理研究所王大成/丁璟珒課題組和邵峰團隊合作,在Nature Structural & Molecular Biology發表題為Structural mechanisms of calmodulin activation of Shigella effector OspC3 to ADP-riboxanate caspase-4/11 and block pyroptosis的研究論文。該研究揭示了效應蛋白OspC3利用宿主細胞的鈣調蛋白(calmodulin,CaM)作為輔助因子激活其酶學活性,特異地識別宿主靶標caspase-4/11並催化全新的精氨酸ADP-riboxanation修飾,阻斷宿主細胞caspase-4/11-GSDMD焦亡通路的完整分子機理。
研究人員發現OspC3可以有效地對靜息狀態未發生自剪切的caspase-4/11和細菌LPS激活後發生自剪切的caspase-4/11兩種形式進行修飾,但是激活形式的caspase-4/11活性中心如果被模擬底物切割位點四肽序列的共價抑製劑zVAD不可逆地占據,會極大地削弱OspC3對caspase-4/11的修飾,這表明底物非結合狀態的caspase-4/11,不論激活與否都是OspC3的底物。研究人員發現,ADP-核糖基特異性結合蛋白Af1521可與修飾後的caspase-4/11產物形成穩定的1:1複合物,通過解析Af1521與caspase-4被修飾後產物的複合物的高分率晶體結構,研究人員清晰地觀察到ADP-riboxanation修飾的精確化學結構,caspase-4修飾位點R314的側鏈胍基脫去一個末端Nω原子後與來自NAD+的ADP-核糖基核糖環上的C1原子和C2位羥基分別連接,形成了一個全新的五元惡唑烷環,該結果為精氨酸ADP-riboxanation這種全新的翻譯後修飾提供了直接的結構證明。
OspC3及其所屬的細菌效應蛋白家族具有典型的雙結構域特征,其N端結構域和任何已知的蛋白質沒有序列同源性,而C端包含一個保守的ankyrin-repeat結構域(ARD),這類結構域通常介導蛋白質相互作用,因此推測該結構域是OspC3的底物識別結構域。研究人員進一步通過解析OspC3 ARD結構域與caspase-4底物複合物的晶體結構,確定了OspC3 ARD結構域通過一係列氫鍵網絡和疏水作用特異地招募宿主靶標caspase-4/11。
在體外重組OspC3修飾caspase-4/11的酶活實驗中,研究人員發現OspC3需要幾乎與底物蛋白caspase-4/11相當的量才能實現對底物的完全修飾,這有悖於酶催化底物反應高效性的經典認識。通過免疫共沉澱結合質譜的方法,研究人員鑒定出宿主的鈣調蛋白CaM以Ca2+-free的形式與OspC3形成穩定的二元複合物,極大提高了OspC3的催化效率。研究人員解析了OspC3與CaM二元複合物的高分辨率晶體結構,發現Ca2+未結合狀態的CaM通過兩個亞結構域分別以廣泛的疏水作用牢牢抓住OspC3的N端結構域,而OspC3的N端結構域呈現出經典Rossmann折疊構象,與已知的ADP-核糖基轉移酶結構域具有相似的結構特征和保守的NAD+結合基序。為了進一步闡明OspC3利用NAD+作為供體催化caspase-4/11的精氨酸發生ADP-riboxanation修飾的完整酶學機理,研究人員解析了OspC3-CaM-caspase-4三元複合物及其與2'-F-NAD+(非水解型NAD+類似物)的四元複合物晶體結構,發現OspC3的N端的酶活中心通過酸性氨基酸D231固定caspase-4活性中心R314側鏈胍基的末端Nω原子,使ADP-核糖基C1位靠近R314胍基的Nδ原子,從而利於NAD+煙酰胺基團的離去和在修飾位點R314 Nδ原子上發生第一步經典的ADP-核糖基修飾;而酶活中心的另一個酸性氨基酸D177則負責激活ADP-核糖基C2位的羥基親核進攻R314側鏈胍基C原子發生脫氨反應,使精氨酸側鏈胍基和ADP-核糖基團形成一個惡唑烷環。研究人員將結構研究的發現利用定點突變的方法在生化、細胞和Shigella感染小鼠三個層麵進行了驗證,完整地闡明了OspC3利用宿主輔因子CaM特異地對caspase-4/11進行精氨酸ADP-riboxanation修飾的分子機理。
該研究通過一係列三維結構分析與功能實驗驗證,揭示了痢疾杆菌效應蛋白OspC3特異地識別宿主天然免疫受體caspase-4/11,並利用宿主鈣調蛋白CaM作為輔因子催化全新的精氨酸ADP-riboxanation修飾,阻斷宿主細胞caspase-4/11-GSDMD焦亡防禦通路的完整分子機理,也為ADP-riboxanation這種全新的翻譯後修飾的酶學反應機理提供了全麵深入的理解,為進一步尋找和開發新型抗菌藥物或細菌減毒疫苗提供了新策略。
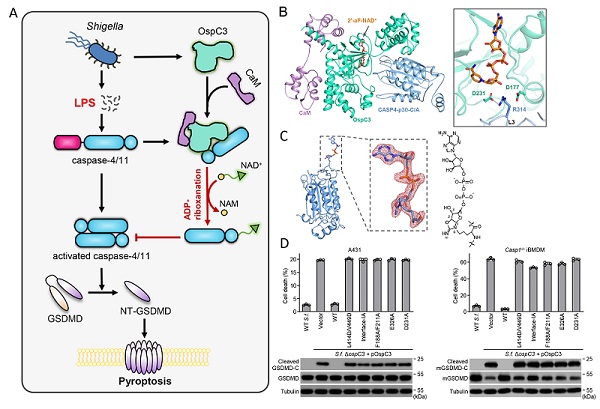
痢疾杆菌效應蛋白OspC3拮抗宿主細胞焦亡通路的分子機理。A.痢疾杆菌效應蛋白OspC3阻斷caspase-4/11焦亡通路拮抗宿主天然免疫的模式圖;B.OspC3-CaM-caspase-4-2'-F-NAD+四元複合物結構及催化關鍵殘基展示;C.精氨酸ADP-riboxanation修飾後的caspase-4結構;D.OpsC3催化關鍵位點突變體在痢疾杆菌侵染細胞實驗中進行驗證。
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號