近日,《新英格蘭醫學雜誌》(NEJM)發表一項中國非劣效性3期隨機對照臨床試驗,其結果表明:與抗病毒藥物Paxlovid相比,服用VV116的患者副作用要少,約有67%報告了副作用,而服用Paxlovid的人報告了77%。 其實,關於VV116的三期臨床試驗,業界有很多質疑,比如主要終點為何設置為臨床恢複而不是預防重症及死亡。中日友好醫院副院長曹彬在12月29日撰文指出初始臨床主要終點設置了轉重
近日,《新英格蘭醫學雜誌》(NEJM)發表一項中國非劣效性3期隨機對照臨床試驗,其結果表明:與抗病毒藥物Paxlovid相比,服用VV116的患者副作用要少,約有67%報告了副作用,而服用Paxlovid的人報告了77%。
其實,關於VV116的三期臨床試驗,業界有很多質疑,比如主要終點為何設置為“臨床恢複”而不是“預防重症及死亡”。中日友好醫院副院長曹彬在12月29日撰文指出初始臨床主要終點設置了轉重和症狀恢複時間。研究團隊為了搶時間,妥協了部分嚴謹性,包括未開展雙盲設計。
有業界專業人士戲稱:“我和劉翔20秒內都能完成百米的非劣比較沒有意義,這個臨床設計策略存在嚴重失策。
其一,Paxlovid共完成三個三期,除了以轉重、死亡率為主要指標的研究成功外,預防性研究和以症狀改善為終點的三期臨床均失敗了;VV116在參比這個失敗的背景下和之頭對頭的非劣比較就人為加大了注冊風險(可能他們也在重新做了),其實與安慰劑做優效更好些;目前全球以所有症狀消失時間為臨床主要觀察指標的新冠治療藥物,隻有鹽野義的恩昔特韋成功了。
其二,受試者選擇不是72小時之內,拖延越久越增加偏倚,入組是好入了,結局不好說了。”
從試驗過程文件,可以發現VV116臨床試驗最終放棄了雙終點,僅保留了症狀緩解時間這一個臨床終點。可能是由於研究團隊在試驗執行過程中發現奧密克戎毒株致病性下降,導致重症事件發生概率極低。也正如預期,結果表明兩組進展為重型的受試者人數為0。
在安全性方麵,VV116比Paxlovid的安全性顧慮更少。VV116組的不良反應發生率低於Paxlovid組。由於Paxlovid與多種藥物存在相互作用,而VV116不會抑製或誘導主要藥物代謝酶,或者抑製主要藥物轉運蛋白,因此與合並用藥發生相互作用可能性小。
我們來看一下VV116的設計思路和阻斷新冠病毒複製的機理,進一步了解這款藥的特點。
VV116(JT001)是中科院上海藥物研究所、武漢病毒研究所和君實科技等團隊開發的口服小分子藥物。VV116是從GS-441524及其衍生物GS-621763改造而來。區別於靶向肝髒的瑞德西韋磷酯酰胺前藥設計,VV116為三異丁酸酯前藥結構,將母體核苷堿基部分C7位的氫進行氘代替換(也起到了突破專利的作用),以氫溴酸鹽形式成藥。
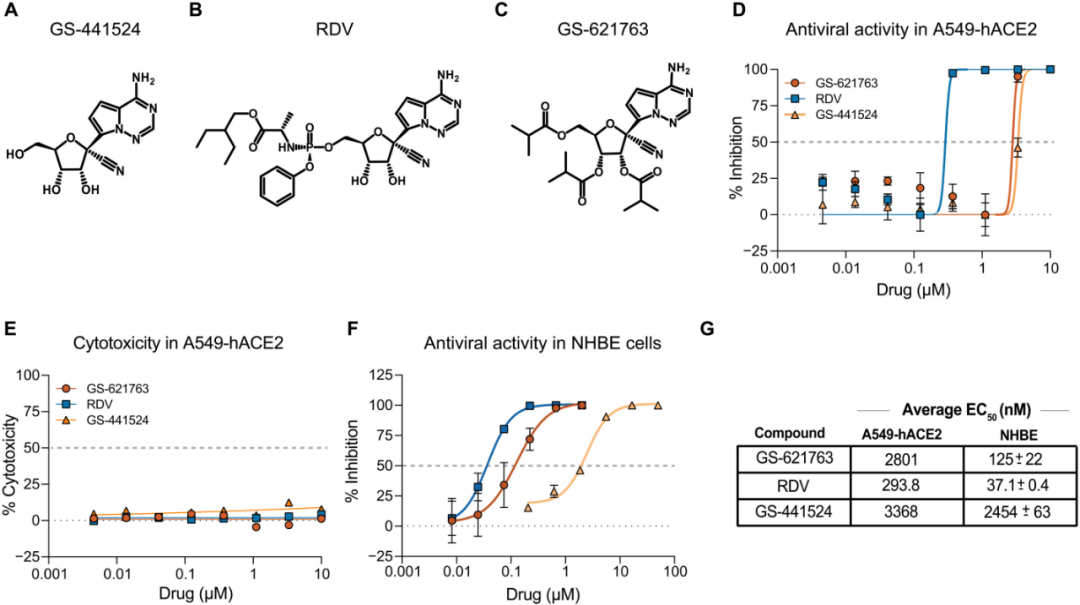
圖1 母體GS441624,衍生物瑞德西韋(RDV)和GS-621763的化學結構和抗病毒活性數據。圖片來源:參考資料2
改造後的VV116具有很高口服生物利用度,口服吸收後,可在體內組織廣泛分布。雖然和FDA批準的瑞德西韋同屬於GS441524的核苷類似物的前藥(Prodrug),但與需靜脈注射的瑞德西韋相比,VV116可以口服給藥,具有良好的口服生物利用度。此外臨床數據顯示VV116表現出更好的體外抗病毒活性和選擇性。VV116於去年12月獲準在烏茲別克斯坦緊急使用。
在3期臨床試驗中,VV116與Paxlovid相比在“至持續臨床恢複的時間”達到非劣效,且VV116組比Paxlovid組的中位恢複時間更短,VV116組為4天,Paxlovid組為5天。但發現感染5天後再吃幾乎沒有效果。
除此之外,VV116的價格在烏茲別克斯坦為185美元(約合人民幣1275元),國內售價據悉定在600至1000元,約為另外兩款口服治療藥物Paxrovid(京東價格2980元/盒)和莫納皮拉韋(Molnupiravir歐美售價每盒700美元約和人民幣4700元)的三分之一。
目前,我國批準使用的Paxrovid和molnupiravir藥物機理也都是抑製病毒在體內複製,防止病毒增殖的抗病毒藥物。在臨床試驗中,當在症狀出現後4天內給予Paxrovid時,住院和死亡的概率降低了89%,即使在5天內給予,該比率仍高達85%。
Molnupiravir公布的臨床結果顯示,在症狀出現後5天內給藥可使住院率和死亡率降低50%,但在最終的臨床分析中該效果降為30%。
由於VV116和瑞德西韋的藥物機理都是通過阻斷病毒遺傳物質RNA的複製來抑製病毒複製的機製。瑞德西韋於2020年10月被美國FDA正式批準用於治療住院的感染新冠病毒的重症患者,此後適用範圍擴大至症狀較輕的患者。FDA還宣布將瑞德西韋的使用範圍擴大到兒科患者和28天或以上且體重至少3公斤的嬰兒。瑞德西韋成為第一個可用於12歲以下兒童和嬰兒的治療藥物側麵體現出藥物的安全性較高。
VV116和瑞德西韋一樣最初以非活性形式存在。因此,下圖中所示的過程說明VV116從其非活性形式轉變成其活性形式(三磷酸化的VV116)的步驟順序。
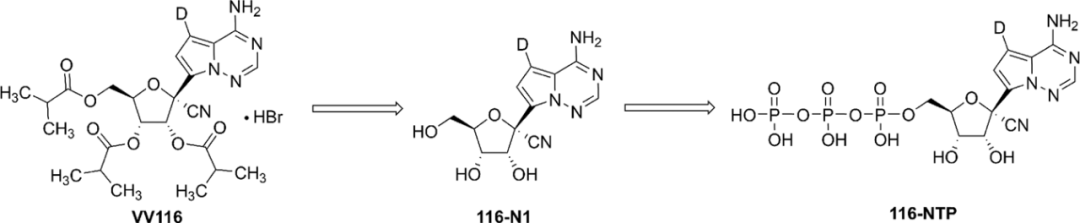
圖2VV116體內代謝為活性化合物的過程。圖片來源:參考資料10
此後,三磷酸化的VV116通過與其天然的三磷酸腺苷(ATP)競爭而抑製病毒RNA聚合酶。在病毒RNA拷貝的合成過程中,通過與RNA模板另一核苷酸中的尿嘧啶堿基配對,添加了三磷酸化的VV116導致病毒子鏈合成的終止。這是VV-116抑製新冠毒複製而又不損害宿主細胞的能力的機製。
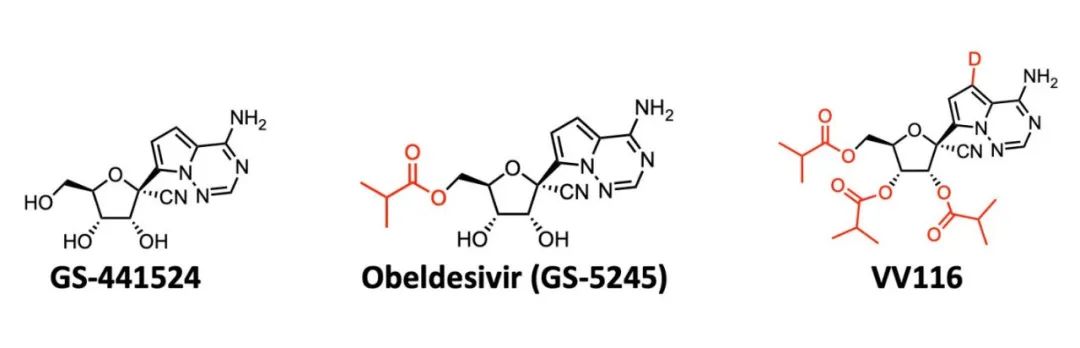
圖3基於母體藥物設計的兩款口服新冠病毒阻斷劑的藥物結構
瑞德西韋的開發者Gilead公司也在積極研發口服劑型的新藥,比如有報道稱用於治療高風險患者的口服GS441524衍生物Obeldesivir(GS-5245)正在進行3期臨床試驗。與母體核苷GS-441524的口服給藥相比,GS-5245顯示出更高的口服生物利用度。這也側麵證明了VV116的確有更好的口服生物利用度。
除了VV116,目前國內在研的新冠口服藥整理如下:其中先聲藥業與中國科學院上海藥物研究所、武漢病毒研究所聯合開發的SIM0417,預計最快於2023年2月上市。
在筆者整理VV116相關資料的時候看到這則新聞:當徐華強教授上個月病倒並檢測出新冠病毒呈陽性時,他服用了自己發明的藥片。
Paxlovid是美國主要的口服抗病毒藥物,在中國供不應求。但是,徐華強教授在2021年幫助設計了自己的藥物,並且作為該藥物的發明者,即使在進行臨床試驗時也可以合法服用。
他的症狀減輕了,而且他並不孤單。在《新英格蘭醫學雜誌》上的一項822名患者的臨床試驗中,抗病毒藥物VV116在緩解患者症狀方麵似乎與Paxlovid一樣有效。服用VV116的新診斷患者在中位4天後康複,而Paxlovid為5天,但專家警告說,該研究的規模還不足以說一個比另一個更好。
該藥物由上海君實和蘇州旺山旺水等機構共同開發。
可以確定的是,這些結果可能會為疫情中的患者和醫生提供一種新工具,幫助他們努力遏製迅速蔓延的疫情,同時最終為世界的武器庫增加另一種抗病毒藥物。
“我希望這些結果的公布能更快地獲得批準,”徐教授在接受采訪時說。
雖然新冠藥物研發充滿坎坷,但依然期待2023年,可以看到更多安全有效的新冠藥物研發成功。
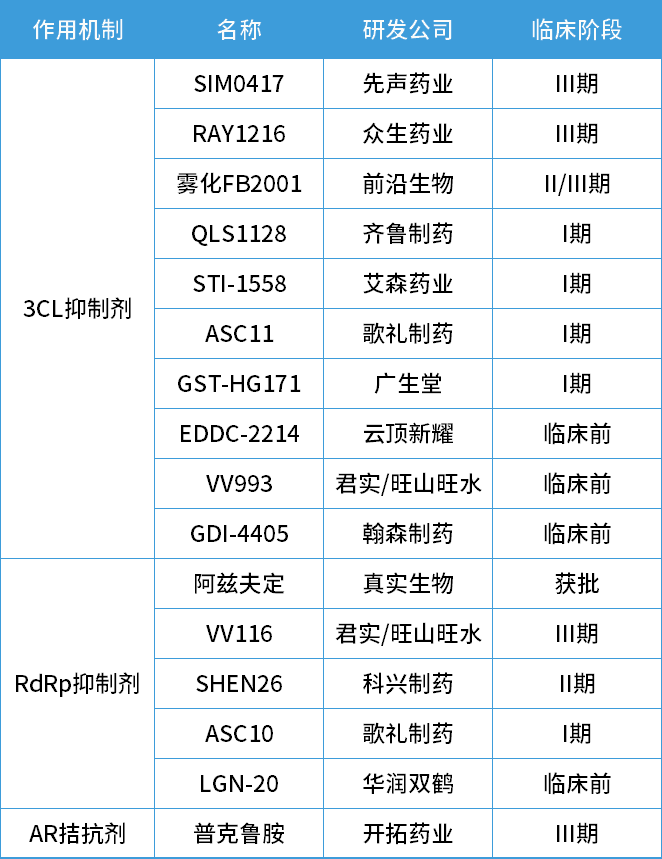
圖5國內在研新冠口服藥物。圖片來源:參考資料4
在此,特別緬懷被病毒奪去生命的患者,他們也許是我們的親人,也許是普通的眼科醫生,也許是藥物所不停奔波的院士,也許是倒在一線的護士……
站在國內外前輩們的肩膀上,讓我們一起努力,期待下一款新冠良藥,源自中國,走向世界。
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號