Lexicon製藥公司近日公布了SGLT 1/2抑製劑類降糖藥Zynquista(sotagliflozin)治療2型糖尿病III期SOTA-EMPA研究的頂線數據。 這是一項多中心、2:2:1隨機、雙盲、安慰劑對照和陽性藥物對照、平行組研究,在約700例接受DPP4抑製劑(聯用或不聯用二甲雙胍)治療但血糖水平控製不佳的2型糖尿病患者中開展,比較了sotagliflozin(400mg)、emp
Lexicon製藥公司近日公布了SGLT 1/2抑製劑類降糖藥Zynquista(sotagliflozin)治療2型糖尿病III期SOTA-EMPA研究的頂線數據。
這是一項多中心、2:2:1隨機、雙盲、安慰劑對照和陽性藥物對照、平行組研究,在約700例接受DPP4抑製劑(聯用或不聯用二甲雙胍)治療但血糖水平控製不佳的2型糖尿病患者中開展,比較了sotagliflozin(400mg)、empagliflozin(25mg)、安慰劑的療效和安全性。研究的主要終點是治療第26周sotagliflozin相對於安慰劑在降低血糖水平(A1C水平從基線的降低)方麵的優越性,關鍵次要終點是治療第26周sotagliflozin相對於empagliflozin在降低血糖水平(A1C水平從基線的降低)方麵的非劣效性。empagliflozin(恩格列淨)是勃林格殷格翰-禮來糖尿病聯盟推出的一款重磅SGLT2抑製劑類降糖藥,品牌名為Jardiance,2018年全球銷售額達到21.2億美元,占據SGLT2抑製劑市場超過50%的份額。
結果顯示,研究達到了主要終點:在接受DPP4抑製劑治療的2型糖尿病患者中,治療第26周,與安慰劑相比,sotagliflozin(400mg)在降低A1C方麵顯示出優越性。此外,研究還達到了關鍵次要終點:治療第26周,與empagliflozin(25mg)相比,sotagliflozin(400mg)在降低A1C方麵顯示出非劣效性。研究中,sotagliflozin的耐受性良好,安全性結果與先前報道的結果一致。
SOTA-EMPA研究是sotagliflozin治療2型糖尿病項目9項核心III期研究中的第4項,該研究的全部結果將在即將召開的醫學會議上公布。
Lexicon製藥公司執行副總裁兼首席醫療官Pablo Lapuerta表示:“我們很高興,今天的結果表明,sotagliflozin的臨床表現與empagliflozin的療效相當,並且具有與之前一致的安全性。我們期待著在2020年初公布sotagliflozin治療2型糖尿病項目其餘核心III期研究的頂線數據。”
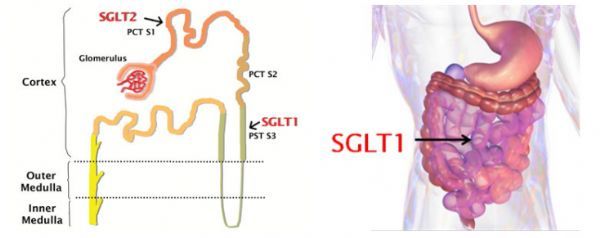
Zynquista的活性藥物成分為sotagliflozin,這是一種SGLT-1/SGLT-2雙效抑製劑,正開發用於1型糖尿病和2型糖尿病的治療。SGLT名為鈉-葡萄糖協同轉運蛋白,有2種類型,SGLT-1主要負責胃腸道中葡萄糖的吸收,SGLT-2主要負責能腎髒的葡萄糖重吸收。
sotagliflozin由Lexicon公司研製,賽諾菲於2015年11月與Lexicon達成17億美元授權協議,獲得了這款藥物除日本以外的全球獨家權利。然而,在今年7月,賽諾菲宣布與Lexicon終止sotagliflozin項目合作。賽諾菲給出的理由是,在治療伴有中度(3期)和重度(4期)慢性腎髒病(CKD)的2型糖尿病患者中開展的2項III期研究(SOTA-CKD3、SOTA-CKD4)中,數據沒有達到賽諾菲的預期目標。
監管方麵,Zynquista於今年4月底獲得歐盟批準,作為胰島素的輔助藥物,用於體重指數≥27kg/m2且接受最佳胰島素療法仍無法達到足夠血糖控製的1型糖尿病(T1D)成人患者。Zynquista通過口服給藥,劑量為每日一次200mg和400mg。但在美國,Zynquista於今年3月下旬被FDA拒絕批準。除了1型糖尿病之外,Zynquista目前也正處於III期臨床開發,用於治療2型糖尿病。該藥的2型糖尿病開發項目共有11項臨床研究,其中包括在伴腎損害的2型糖尿病患者中開展的2項研究,以及2項大型心血管結局研究。
SGLT抑製劑是一類新的降糖藥,在2型糖尿病治療方麵已取得了巨大成功。目前,有多家藥企正開發SGLT抑製劑治療1型糖尿病(T1D)和心力衰竭。1型糖尿病方麵,迄今已有3款SGLT藥物獲批,包括安斯泰來Suglat(伊格列淨L-脯氨酸,獲日本批準)、阿斯利康Forxiga(達格列淨,獲歐盟、日本批準)、Lexicon公司Zynquista(索格列淨,或歐盟批準)。

盡管在歐盟和日本市場已有多款SGLT抑製劑獲批治療1型糖尿病(T1D),但在美國方麵至今尚無一款SGLT抑製劑獲得批準。今年3月和7月,Zynquista和Farxiga分別被FDA拒絕批準治療T1D,原因均為:與安慰劑組相比,實驗組有較高比例的患者發生酮症酸中毒(DKA)事件。DKA是一種常見的糖尿病並發症,在T1D患者中的發生率比T2D患者中高。
今年11月中旬,FDA內分泌和代謝藥物谘詢委員會(EMDAC)對勃林格殷格翰-禮來糖尿病聯盟empagliflozin 2.5mg治療1型糖尿病適應症做出了高票反對建議。在藥物審查過程中,谘詢委員會向FDA提供來自外部醫學專家的獨立意見和建議。FDA沒有義務遵循谘詢委員會的建議,但經常都會這樣做。這也意味著,empagliflozin 2.5mg治療1型糖尿病的新適應症申請很有可能最終被FDA拒絕批準。目前,FDA尚未做出最終決定,empagliflozin究竟能否化解險情、破除魔咒、實現零突破,讓我們拭目以待!(生物穀Bioon.com)
原文出處:LEXICON PHARMACEUTICALS ANNOUNCES TOPLINE PHASE 3 DATA FOR SOTAGLIFLOZIN IN TYPE 2 DIABETES
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號