急性呼吸窘迫綜合征患者的急性右心室損傷表型分析 急性呼吸窘迫綜合征(ARDS)患者出現右心室(RV)損傷與增加病死率顯著相關,給臨床救治帶來挑戰。最近9項關於ARDS研究(n=1861)的係統綜述和薈萃分析發現,21%的患者出現RV損傷,定義為RV功能障礙、急性肺心病(ACP)、RV功能障礙伴血流動力學損傷或RV功能衰竭。這篇最新的文章中,我們旨在討論ARDS中RV生物力學異常的機製和RV損傷表
急性呼吸窘迫綜合征患者的急性右心室損傷表型分析
急性呼吸窘迫綜合征(ARDS)患者出現右心室(RV)損傷與增加病死率顯著相關,給臨床救治帶來挑戰。最近9項關於ARDS研究(n=1861)的係統綜述和薈萃分析發現,21%的患者出現RV損傷,定義為RV功能障礙、急性肺心病(ACP)、RV功能障礙伴血流動力學損傷或RV功能衰竭。這篇最新的文章中,我們旨在討論ARDS中RV生物力學異常的機製和RV損傷表型特征。了解RV損傷的病理生理學和自然史,有助於為重症醫師診斷和監測RV損傷,以及潛在個性化治療措施提供依據。
一、ARDS中RV損傷的定義和表型
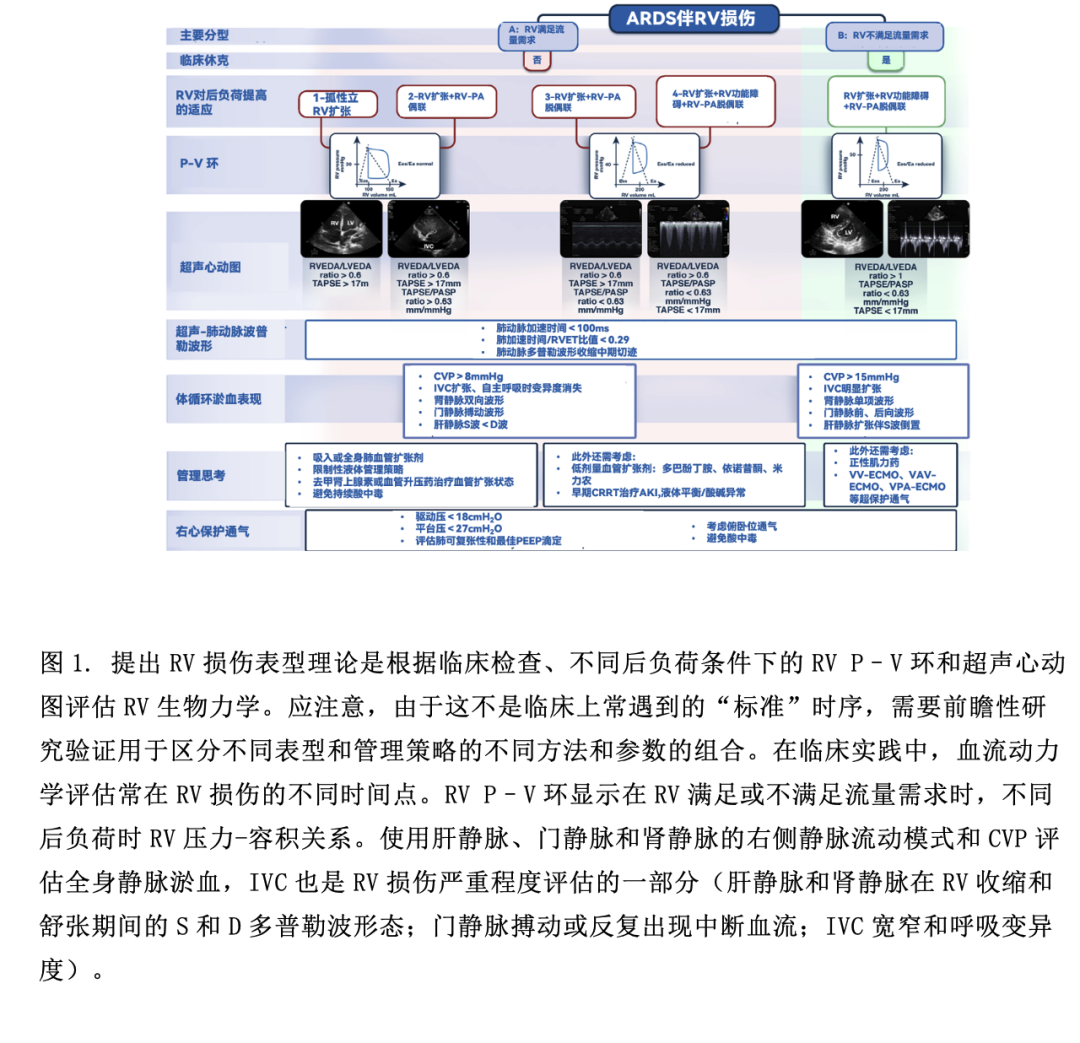
大部分RV損傷的定義聚焦於晚期RV損傷,這種損傷可能已經難以救治。最近在2019新型冠狀病毒病(COVID-19)ARDS患者中發現三種不同RV損傷表型(RV功能正常、RV擴張、RV擴張伴收縮功能障礙),這三種表型與不同的臨床結局相關。最近一項包括COVID-19相關ARDS患者的多國研究發現,RV損傷的ACP表型[定義為:右、左室舒張末期麵積比(RVEDA/LVEDA)>0.6,室間隔運動異常]與增加病死率相關。孤立性RV擴張或RV擴張伴功能障礙,無論是否伴有靜脈淤血[中心靜脈壓力(CVP)≥ 8 mmHg,右側靜脈血流充盈模式:如肝靜脈、門靜脈和腎靜脈或下腔靜脈(IVC)寬窄和經超聲心動圖評估的IVC呼吸變異],RV偶爾可通過Frank–Starling機製代償來滿足流量需求(圖1)。在靜脈淤血的情況下,由於灌注壓(平均動脈壓-靜脈壓)降低,可導致繼發器官損傷(腎或肝髒)。盡管早期RV通過Frank–Starling機製代償,但RV功能進一步損傷、擴張和RV無法滿足流量需求會導致休克,進展為晚期RV衰竭。然而,值得注意的是,ARDS中的RV損傷表型、表型終點和隨時間推移的表型間轉換並無大數據依據。在最初的血液動力學評估和後期RV損傷進程中,尤其是當呼吸功能惡化時,不同階段RV損傷間可存在相互重疊。這與ARDS中RV損傷的潛在機製有關,即使對RV進行評估(如超聲心動圖),RV損傷在時間序列上的表型也頗具挑戰性。
二、ARDS中RV損傷的機製
1.心血管機製和右心室-肺動脈偶聯
不同後負荷下RV和肺動脈(PA)之間相互作用,即RV-PA偶聯。其決定了RV收縮性(用收縮末期彈性Ees測量)和PA後負荷(用肺動脈彈性Ea測量)之間的力學融合關係(圖1)。應強調的是,RV後負荷指的是肺血管舒縮張力,是阻力和搏動的共同作用,而不僅指肺血管阻力。當Ees/Ea>1時,RV-PA偶聯。由於阻塞(血栓形成和肺血管重塑)、壓迫(肺水腫和不適當的有創通氣)和肺血管收縮(低氧血症、高CO2、酸中毒等)導致急性肺動脈高壓(PA)。PA導致RV收縮力增加,以代償RV後負荷增加(等容代償或Anrep機製),危重病時,由於全身炎症反應和低血壓,這種代償能力會受限。隨後RV擴張以維持血流量(異形代償),以及Ees/Ea<1(Ea升高引起)導致RV-PA脫偶聯,RV和LV舒張之間經跨室間隔相互作用,RV舒張末期壓力超過LV舒張末期壓力,使LV充盈和心輸出量CO降低。由於CO和體循環壓力降低,冠脈灌注壓降低,以及全身及RV壓力降低,導致RV僅舒張期存灌注,從而導致RV心肌缺血。RV和LV之間的跨室間隔相互作用加劇了RV-PA脫偶聯,導致體循環休克,RV功能無法滿足流量需求(晚期RV損傷或RV衰竭)(圖1)。盡管RV-PA脫偶聯機製在生理上是合理的,但無法預測從急性等容代償到異行代償至失代償導致晚期RV損傷和休克的臨界點。此外,RV對後負荷變化的非線性適應,加上危重症中RV固有收縮功能儲備下降,可解釋為什麼在ARDS中評估不同RV血流動力學/超聲心動圖表型在時序上表現是一個挑戰,使RV損傷成為複雜的臨床綜合征。
2.心肺“串擾”和醫源性機製
右心室後負荷在肺容積極限時最高。嚴重ARDS患者的功能殘氣量(FRC)顯著降低,當跨肺壓超過肺靜脈壓時,有創通氣引起的非生理性應力(跨肺壓)和應變(潮氣量與FRC比值)會導致RV後負荷升高。肺容積降低會導致終末氣道和肺泡外血管塌陷,而肺容積升高時,肺泡壁張力和肺泡內血管塌陷增加,都會導致RV後負荷升高。驅動壓(平台壓-呼氣末正壓)≥ 18 cm H2O已確定為中-重度ARDS患者發生ACP的危險因素。此外,在危重症或膿毒性心肌病時,RV固有收縮能力下降會惡化RV功能。
三、多模式診斷和監測RV損傷
可結合超聲心動圖、肺血流動力學監測和臨床檢查來評估ARDS中RV收縮力和後負荷的匹配性以及RV對後負荷急性變化的適應過程(圖1)。RV-PA偶聯可使用超聲心動圖[三尖瓣環平麵收縮偏移(TAPSE)/肺動脈收縮壓(PASP)比值]進行無創評估。雖然TAPSE/PASP比值在COVID-19相關ARDS中與RV-PA偶聯及臨床結局密切相關,但需要多中心前瞻性研究來證明這種相關性。超聲心動圖衍生的舒張和收縮參數以及使用帶有RV監測端口的肺動脈導管監測RV舒張壓波形可用於評估RV-PA偶聯、嚴重程度和RV損傷表型。這種方法可以監測RV損傷和肺血管功能障礙的進展,動態評估對治療的反應。然而,應開展大規模前瞻性研究驗證多模式診斷和檢測RC損傷的優勢。
四、RV損傷管理策略
ARDS中RV損傷的藥物治療包括:改善RV-PA偶聯的血管活性藥物(如血管擴張劑),通過保持體循環壓力高於PA壓力來維持冠脈灌注壓(如血管加壓劑),減少RV後負荷藥物(如肺血管擴張劑)(圖1)。非藥物治療包括:(a)RV保護性通氣;(b) 俯臥位通氣;(c)體外膜氧合[(ECMO)靜脈-靜脈、靜脈-動脈-靜脈、靜脈-肺動脈]。ECMO可以逆轉促進RV後負荷增加因素(低氧血症、高CO2、酸中毒)以及降低應力/應變(即“RV保護”通氣),有助於卸載“受傷”的RV(圖1)。鑒於RV損傷提高病死率以及ECMO可以改善此類患者的病理生理狀態,未來的前瞻性研究應評估在選擇ECMO支持患者時,是否應針對重度ARDS伴有RV損傷的亞型。上述方法,尤其是機械性輔助RV支持策略,在很大程度上是基於對疾病發生機製和病理生理學的理解,而非循證醫學,圖1推薦的算法流程仍有待驗證。
copyright©醫學論壇網 版權所有,未經許可不得複製、轉載或鏡像
京ICP證120392號 京公網安備110105007198 京ICP備10215607號-1 (京)網藥械信息備字(2022)第00160號